
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)为原料,制备粗铅,实现铅的再生利用.其工作流程如图1所示:
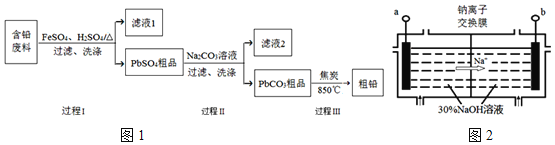
已知:Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14.
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是______.
(2)过程Ⅰ中,Fe2+催化过程可表示为:
![]()
![]() .
.
![]() 写出ii的离子方程式:______.
写出ii的离子方程式:______.
![]() 下列实验方案可证实上述催化过程.将实验方案补充完整.
下列实验方案可证实上述催化过程.将实验方案补充完整.
![]() 向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红.
向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红.
![]() ______.
______.
(3)过程Ⅱ的目的是脱硫.若滤液2中c(SO42-)=1.6molL-1,c(CO32-)=0.1molL-1,则PbCO3中______![]() 填“是”或“否”
填“是”或“否”![]() 混有PbSO4.
混有PbSO4.
(4)钠离子交换膜固相电解法是从含铅废料中提取铅的一种新工艺,其装置如图2所示.将含铅废料投入阴极室,含铅废料中的PbSO4与NaOH溶液发生反应:![]()
![]() 与外接电源的______极相连.
与外接电源的______极相连.
![]() 电解过程中,PbO2、PbO、HPbO2-在阴极放电,其中PbO2放电的电极反应式为______.
电解过程中,PbO2、PbO、HPbO2-在阴极放电,其中PbO2放电的电极反应式为______.
![]() 与传统无膜固相电解法相比,使用钠离子交换膜可以提高Pb元素的利用率,原因是______.
与传统无膜固相电解法相比,使用钠离子交换膜可以提高Pb元素的利用率,原因是______.
【答案】![]() 4
4![]()
![]()
![]() 取a中红色溶液少量,加入足量Pb,充分反应后,红色褪去 否 负
取a中红色溶液少量,加入足量Pb,充分反应后,红色褪去 否 负 ![]() 阻止HPbO2-进入阳极室被氧化
阻止HPbO2-进入阳极室被氧化
【解析】
(1)在催化下,Pb、PbO2和H2SO4反应生成PbSO4和水,据此书写反应方程式;
(2)①根据题给信息知反应i中Fe2+被PbO2氧化为Fe3+,则反应ii中Fe3+被Pb还原为Fe2+,据此书写离子方程式;
②加入过量的Pb平衡逆向进行充分反应后,红色褪去;
(3)根据Ksp(PbCO3)=3.3×10-14和c(CO32-)=0.1molL-1计算出c(Pb2+)利用浓度积Qc和Ksp(PbSO4)之间的大小关系确定PbCO3中是否混有PbSO4;
(4)①根据钠离子的移动方向确定阴阳极;
②电解过程中,PbO2在阴极得电子,发生还原反应;
③钠离子交换膜只允许钠离子通过。
(1)根据题给化学工艺流程知,过程Ⅰ中,在催化下,Pb、PbO2和H2SO4反应生成PbSO4和水,化学方程式为:![]()
![]()
![]() ;
;
(2)①催化剂通过参加反应,改变反应历程,降低反应的活化能,加快化学反应速率,而本身的质量和化学性质反应前后保持不变,根据题给信息知反应i中Fe2+被PbO2氧化为Fe3+,则反应ii中Fe3+被Pb还原为Fe2+,离子方程式为:![]() ;
;
②a实验证明发生反应i,则b实验需证明发生反应ii,实验方案为:
![]() 向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红,亚铁离子被氧化为铁离子,
向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红,亚铁离子被氧化为铁离子,
![]() 取a中红色溶液少量,溶液中存在平衡,
取a中红色溶液少量,溶液中存在平衡,![]() ,加入过量Pb,和平衡状态下铁离子反应生成亚铁离子,平衡逆向进行充分反应后,红色褪去,
,加入过量Pb,和平衡状态下铁离子反应生成亚铁离子,平衡逆向进行充分反应后,红色褪去,
(3)因为Ksp(PbCO3)=3.3×10-14和c(CO32-)=0.1molL-1,可知c(Pb2+)=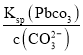 =
=![]() mol/L=3.3×10-13 mol/L , 因此Qc= c(Pb2+) c(SO42-)=3.3×10-13×1.6=5.28×10-13< Ksp(PbSO4),说明PbSO4在母液中未饱和,即PbCO3中不混有PbSO4;
mol/L=3.3×10-13 mol/L , 因此Qc= c(Pb2+) c(SO42-)=3.3×10-13×1.6=5.28×10-13< Ksp(PbSO4),说明PbSO4在母液中未饱和,即PbCO3中不混有PbSO4;
(4)①根据钠离子向阴极移动知,b为阴极,与电源负极相连;
②电解过程中,PbO2在阴极得电子,发生还原反应,电极反应式为![]() ;
;
③钠离子交换膜只允许钠离子通过,阻止HPbO2-进入阳极室被氧化,从而提高Pb元素的利用率;


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】元素周期表中七个周期可填充的元素种类如下表所示:
周期数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
元素种类 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
(1)第6、7周期均比第4、5周期多了14种元素,其原因是__。
(2)周期表中__族所含元素最多。
(3)请分析周期数与元素种类的关系,可推测出第8周期可能含有的元素种类为__(填序号)。
A.18 B.32 C.50 D.64
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸在生活和生产中应用广泛。
Ⅰ 某工厂以黄铁矿(主要成分为FeS2)为原料,采用“接触法”制备硫酸。
已知298 K和101 kPa条件下:
2FeS2(s)=2FeS(s)+S(s) ΔH1
S(s)+2O2(g)=2SO2(g) ΔH2
4FeS(s)+7O2(g)=2Fe2O3(s)+4SO2(g) ΔH3
则在该条件下FeS2与O2生成Fe2O3和SO2的总热化学方程式是________。
Ⅱ 催化氧化反应:2SO2(g)+O2(g)2SO3(g) ΔH<0
(1) 在体积可变的密闭容器,维持压强为1×105 Pa和初始n(SO2)=2 mol,充入一定量的O2,SO2平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图所示:
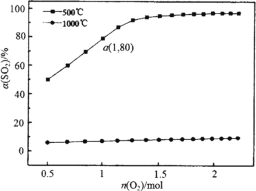
①在1000℃时,SO2平衡转化率随着O2物质的量的增大缓慢升高,解释其原因________。
②a点时SO3的平衡分压p(SO3)=________Pa(保留2位有效数字,某组分的平衡分压=总压×某组分的物质的量分数)。
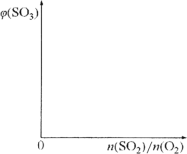
(2)保持温度不变,向固定体积的密闭容器中充入一定量的SO2、O2。请画出平衡体系中SO3的体积分数φ(SO3)随初始SO2、O2的物质的量之比[n(SO2)/n(O2)]的变化趋势图。
(3)已知活化氧可以把SO2快速氧化为SO3。根据计算机模拟结果,在炭黑表面上O2转化为活化氧的反应历程与能量变化如图所示。下列说法正确的是________。
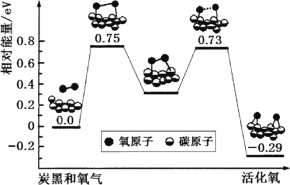
A O2转化为活化氧是氧氧键的断裂与碳氧键的生成过程
B 该过程中最大能垒(活化能)E正=0.73 eV
C 每活化一个O2吸收0.29 eV的能量
D 炭黑可作为SO2转化为SO3的催化剂
E 其它条件相同时,炭黑颗粒越小,反应速率越快
Ⅲ 硫酸工厂尾气中的SO2可被NaOH溶液吸收,用惰性电极将所得的Na2SO3溶液进行电解,可循环再生NaOH的同时得到H2SO4,写出阳极的电极方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是有机合成重要的中间体,其合成路线如图:
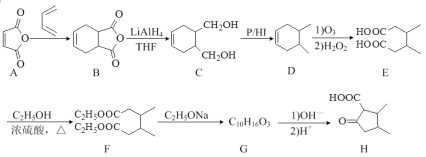
(1)H中官能团的名称为_________。
(2)B→C的反应类型为________。
(3)![]() 的名称为 _______。
的名称为 _______。
(4)化合物G的结构简式为 _______。
(5)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①能与FeCl3溶液发生显色反应;
②碱性水解后酸化,所得两种产物分子均只有2种不同化学环境的氢原子。
(6)以乙烯和![]() 为原料,制备
为原料,制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)____________________。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种元素为短周期元素,其原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族;A与B形成离子化合物,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子分子。试回答下列问题:
(1)写出五种元素名称A________,B________,C________,D________,E________;
(2)用电子式表示A2C的形成过程________________________________;
(3)D与E形成常见离子的空间构型为________________;
(4)A、B两元素形成的化合物A2B2属于__________晶体(填类型),晶体内存在的化学键有___________;A2B晶体的熔点_______(填“>”“=”“<”)A2C晶体的熔点;
(5)由A、B、C、E四种元素,可以共同形成两种不同化合物,它们的水溶液可以反应生成一种气体,请写出离子方程式:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年5月1日起,新版《北京市生活垃圾管理条例》正式实施,下列垃圾分类对应不正确的是
|
|
|
|
A. 鸡蛋壳、剩饭菜 | B. 市民使用后一次性口罩 | C. 过期药品 | D. 一 次性干电池 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行有关电解食盐水的探究实验,电解装置如图所示。
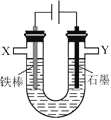
实验一:电解饱和食盐水。
(1)配制饱和食盐水所需的玻璃仪器有:烧杯、量筒、_________________。
(2)电解饱和食盐水的化学方程式为________________。
实验二:电解不饱和食盐水及产物分析。
相同条件下,电解1mol·L-1 NaCl溶液并收集两极产生的气体。在X处收集到V1mL气体,同时,在Y处收集到V2mL气体,停止电解。结果发现V2<V1,且与电解饱和食盐水相比,Y处收集到的气体颜色明显较浅。经讨论分析,导致上述现象的原因有:
ⅰ.有部分Cl2溶于NaCl溶液中;ⅱ.有O2生成。
(3)设计实验证明有部分Cl2溶于NaCl溶液中。实验方案为:取少量__________电极附近溶液。
(4)证明有O2生成并测定O2的体积。按如右图所示装置进行实验,通过注射器缓缓地将在Y处收集到V2mL气体全部推入装置A(盛有足量试剂NaOH溶液)中,最终,量气管中收集到V3mL气体(设V1、V2、V3均在相同条件下测得)。
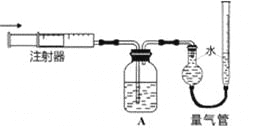
①装置A的作用是_______________。
②本实验中,观察到________________的现象,说明石墨电极上有O2生成。
③实验中是否需要预先除尽装置中的空气?____________(填“是”或“否”)。
(5)实验二中,在石墨电极上产生的Cl2的总体积为________mL(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W、G在元素周期表中的相对位置如下表所示,其中Q是无机非金属材料的主角。下列判断正确的是( )
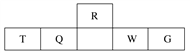
A. 离子半径:T<W<G
B. 等物质的量的W、G单质分别与足量铁粉反应,后者消耗的铁粉多
C. 最简单气态氢化物的热稳定性:Q<R
D. T和G组成的化合物溶于水,其水溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关![]() 反应的叙述正确的为
反应的叙述正确的为
A.还原剂与氧化剂物质的量之比为5:3
B.生成lmolO2,反应共转移4mol电子
C.若有5mol水做还原剂时,被BrF3还原的BrF3为![]() mol
mol
D.若有5mol水参与反应时,被水还原的BrF3为2mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com