
【题目】已知五种元素为短周期元素,其原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族;A与B形成离子化合物,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子分子。试回答下列问题:
(1)写出五种元素名称A________,B________,C________,D________,E________;
(2)用电子式表示A2C的形成过程________________________________;
(3)D与E形成常见离子的空间构型为________________;
(4)A、B两元素形成的化合物A2B2属于__________晶体(填类型),晶体内存在的化学键有___________;A2B晶体的熔点_______(填“>”“=”“<”)A2C晶体的熔点;
(5)由A、B、C、E四种元素,可以共同形成两种不同化合物,它们的水溶液可以反应生成一种气体,请写出离子方程式:___________________________________。
【答案】钠 氧 硫 氮 氢 ![]() 正四面体 离子晶体 离子键、非极性共价键 > HSO
正四面体 离子晶体 离子键、非极性共价键 > HSO![]() +H+=H2O+SO2↑
+H+=H2O+SO2↑
【解析】
以![]() 为突破口,所有离子的电子数相同,且电子总数为30,因此每个离子有10个电子,因此A为钠,B为氧,结合题干中给出的其它信息,C为硫,D为氮,E为氢,据此来分析本题即可。
为突破口,所有离子的电子数相同,且电子总数为30,因此每个离子有10个电子,因此A为钠,B为氧,结合题干中给出的其它信息,C为硫,D为氮,E为氢,据此来分析本题即可。
(1)根据分析,写出各字母所代表的元素名称即可;
(2)![]() 即硫化钠,用电子式表示其形成过程为
即硫化钠,用电子式表示其形成过程为 ![]() ;
;
(3)D和E形成的简单离子即![]() ,
,![]() 和甲烷一样,均为正四面体;
和甲烷一样,均为正四面体;
(4)钠和氧形成的化合物即过氧化钠,过氧化钠属于离子晶体,其中![]() 内部存在共价键,而
内部存在共价键,而![]() 与
与![]() 之间自然是以离子键的形式结合的;结构相似的离子晶体,其熔沸点与成键离子的半径大小成反比,即成键离子的半径越大,其熔沸点越低,而
之间自然是以离子键的形式结合的;结构相似的离子晶体,其熔沸点与成键离子的半径大小成反比,即成键离子的半径越大,其熔沸点越低,而![]() 的半径很显然小于
的半径很显然小于![]() ,因此氧化钠的熔点高于硫化钠;
,因此氧化钠的熔点高于硫化钠;
(5)根据题意,这四种元素可以形成![]() 和
和![]() 两种物质,二者之间反应可以得到
两种物质,二者之间反应可以得到![]() 气体,离子方程式为
气体,离子方程式为![]() 。
。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】下列实验原理和装置能达到实验目的的是
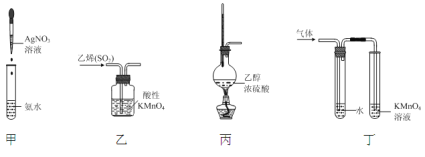
A.装置甲:制取银氨溶液B.装置乙:除去乙烯中混有的SO2
C.装置丙:制取乙烯D.装置丁:验证溴乙烷在氢氧化钠醇溶液加热条件下发生了消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】临床证明磷酸氯喹对治疗“新冠肺炎”有良好的疗效。磷酸氯喹的结构如图所示。下列有关磷酸氯喹的说法错误的是( )
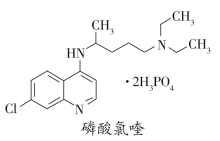
A.分子式是C18H32ClN3O8P2
B.能发生取代、加成和消去反应
C.1mol磷酸氯喹最多能与5molH2发生加成反应
D.分子中的—C1被—OH取代后的产物能与溴水作用生成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。钛酸钡晶体的晶胞结构示意图如图所示,它的化学式是

A. BaTi8O12
B. BaTiO3
C. BaTi2O4
D. BaTi4O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种药物合成的中间体,F的一种合成路线如下:

已知:

回答下列问题:
(1)![]() 的名称为____。
的名称为____。
(2)D中含氧官能团的名称为____。
(3)B→C的反应方程式为____。
(4)D→E的反应类型为____。
(5)C的同分异构体有多种,其中苯环上连有—ONa、2个—CH3的同分异构体还有____种,写出核磁共振氢谱为3组峰,峰面积之比为6:2:1的同分异构体的结构简式____。
(6)依他尼酸钠( )是一种高效利尿药物,参考以上合成路线中的相关信息,设计以
)是一种高效利尿药物,参考以上合成路线中的相关信息,设计以![]() 为原料(其他原料自选)合成依他尼酸钠的合成路线。________________
为原料(其他原料自选)合成依他尼酸钠的合成路线。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)为原料,制备粗铅,实现铅的再生利用.其工作流程如图1所示:
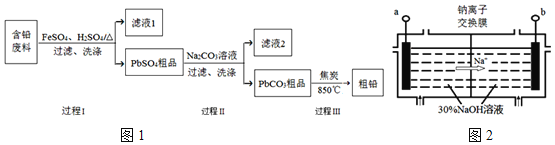
已知:Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14.
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是______.
(2)过程Ⅰ中,Fe2+催化过程可表示为:
![]()
![]() .
.
![]() 写出ii的离子方程式:______.
写出ii的离子方程式:______.
![]() 下列实验方案可证实上述催化过程.将实验方案补充完整.
下列实验方案可证实上述催化过程.将实验方案补充完整.
![]() 向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红.
向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红.
![]() ______.
______.
(3)过程Ⅱ的目的是脱硫.若滤液2中c(SO42-)=1.6molL-1,c(CO32-)=0.1molL-1,则PbCO3中______![]() 填“是”或“否”
填“是”或“否”![]() 混有PbSO4.
混有PbSO4.
(4)钠离子交换膜固相电解法是从含铅废料中提取铅的一种新工艺,其装置如图2所示.将含铅废料投入阴极室,含铅废料中的PbSO4与NaOH溶液发生反应:![]()
![]() 与外接电源的______极相连.
与外接电源的______极相连.
![]() 电解过程中,PbO2、PbO、HPbO2-在阴极放电,其中PbO2放电的电极反应式为______.
电解过程中,PbO2、PbO、HPbO2-在阴极放电,其中PbO2放电的电极反应式为______.
![]() 与传统无膜固相电解法相比,使用钠离子交换膜可以提高Pb元素的利用率,原因是______.
与传统无膜固相电解法相比,使用钠离子交换膜可以提高Pb元素的利用率,原因是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列表格,回答有关问题:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
一 | ||||||||
二 | a | b | c | d | ||||
三 | e | f | g | h | i | j | k | l |
(1)上表中,a元素的元素符号为____,第一电离能最小的元素是____(填元素名称,下同),电负性最大的元素是___。
(2)这些元素的最高价氧化物对应的水化物中,酸性最强的是____(填化学式,下同),碱性最强的是_____。
(3)某元素最高价氧化物对应的水化物呈两性,则该元素是/span>_____(填对应的字母),该元素与c元素形成的化合物能否与NaOH溶液反应(若能,写出相应的离子方程式;若不能,则填“否”)_______。
(4)在e~k元素的原子中,原子半径最小的是_____(填元素符号),其价电子排布式为_________;未成对电子数最多的是____(填元素符号),其最高价氧化物对应水化物的化学式为_____;有两个未成对电子的元素是____(填元素符号);M层有两个空轨道的是____(填元素符号),其阳离子结构示意图为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,某可逆反应的正反应速率和逆反应速率随时间变化的曲线如下 ,下列有关说法不正确的是
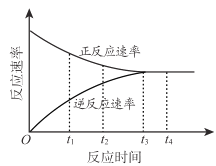
A.t1 时刻,反应向逆反应方向进行
B.t2 时刻,正反应速率大于逆反应速率
C.t3 时刻,反应刚好达到平衡状态
D.t4时刻,反应限度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+3H2O2==NH4BO2+4H2O 。已知H2O2足量,下列说法正确的是( )

A. 正极的电极反应式为2H++2e-===H2↑
B. 电池工作时,H+通过质子交换膜向负极移动
C. 电池工作时,正、负极分别放出H2和NH3
D. 工作足够长时间后,若左右两极室质量差为1.9 g,则电路中转移0.6 mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com