
【题目】下列实验原理和装置能达到实验目的的是
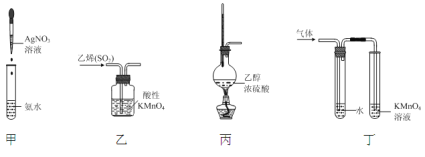
A.装置甲:制取银氨溶液B.装置乙:除去乙烯中混有的SO2
C.装置丙:制取乙烯D.装置丁:验证溴乙烷在氢氧化钠醇溶液加热条件下发生了消去反应
【答案】D
【解析】
A.制取银氨溶液,向AgNO3溶液中滴加氨水,至开始生成的沉淀恰好溶解,得到银氨溶液,而不是向氨水中滴加AgNO3溶液,A错误;
B.二氧化硫、乙烯均能被高锰酸钾溶液氧化,不能用酸性KMnO4溶液除去乙烯中的杂质,B错误;
C.乙醇在浓硫酸作催化剂的作用下加热到170℃发生消去反应得到乙烯,温度计应测量反应液的温度,水银球应放入反应液中,C错误;
D.溴乙烷在氢氧化钠醇溶液加热的条件下发生了消去反应生成乙烯,用高锰酸钾检验生成的乙烯。由于乙醇易挥发,乙烯中含有杂质乙醇,但是乙醇也能被高锰酸钾氧化,会对乙烯的检验产生干扰,实验中用水除去乙烯中的乙醇,排除干扰,可以达到实验目的,D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A.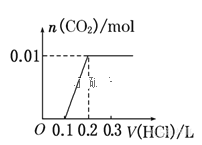 B.
B.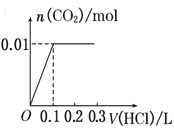
C.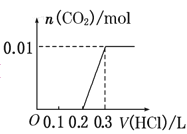 D.
D.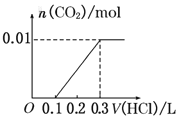
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表诞生150周年,目前周期表七个周期均已排满,共118种元素。短周期元素W、X、Y、Z在周期表中的相对位置如图所示,且四种元素的原子最外层电子数之和为24。
下列说法不正确的是

A. 最高价氧化物对应水化物的酸性:Z>Y
B. W的氢化物与Z的氢化物反应,产物的水溶液呈碱性
C. 在元素周期表中,117号元素与Z元素位于同一主族
D. 工业上常用YX2漂白纸浆、毛、丝等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在生产、生活中有广泛的应用。某研究性学习小组的同学对铜常见化合物的性 质和制备进行实验探究,研究的问题和过程如下:
I.探究不同价态铜的稳定性,进行如下实验:
(1)向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子方程式为:______。由此可知,在酸性溶液中,+2价Cu比+1价Cu更______(填“稳定”或“不稳定”)。
(2)将CuO粉末加热至1000℃以上完全分解成红色的Cu2O粉末,该反应说明:在高温条件下,+1价的Cu比+2价Cu更________(填“稳定”或“不稳定”)。
II.制取硫酸铜(装置如图1)
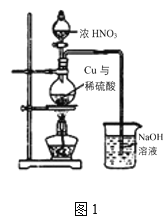
(3)烧瓶内发生的主要反应的化学方程式为______(已知烧杯中反应:2NaOH+2NO2=NaNO3+NaNO2+H2O)
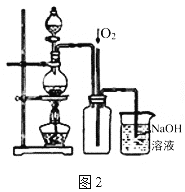
(4)图2是图1的改进装置,其中直玻璃管通入氧气的作用是________。
Ⅲ.探究用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl22H2O)。
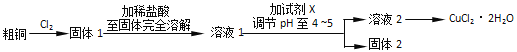
(5)实验室采用如图所示的装置,可将粗铜与Cl2反应转化为固体l(部分仪器和夹持装置已略去),有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要______(填“是”或“否”),试剂x为______。
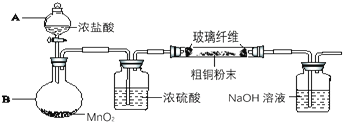
(6)将溶液2转化为CuCl22H2O的操作过程中,发现溶液颜色由蓝色变为绿色。已知:在氯化铜溶液中有如下转化关系:[Cu(H2O)4]2+(aq,蓝色)+4Cl-(aq)![]() CuCl42-(aq,黄色)+4H2O(l),该小组同学取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是______(填序号)(已知:较高浓度的CuCl42-溶液呈绿色)。
CuCl42-(aq,黄色)+4H2O(l),该小组同学取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是______(填序号)(已知:较高浓度的CuCl42-溶液呈绿色)。
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失
(7)若制得的CuCl22H2O晶体仍然含有较多杂质,则可采用_______(填方法名称)进行提纯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,向10 mL 0.01 mol·L-1 NaCN溶液中逐滴加入0.01 mol·L-1的盐酸,其pH变化曲线如下图甲所示。NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如下图乙所示[其中a点的坐标为(9.5,0.5)]。
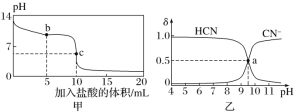
下列溶液中的关系一定正确的是( )
A.图乙中pH=7的溶液:c(Cl-)=c(HCN)
B.常温下,NaCN的水解平衡常数:Kh(NaCN)=10-9.5
C.图甲中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D.图甲中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中七个周期可填充的元素种类如下表所示:
周期数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
元素种类 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
(1)第6、7周期均比第4、5周期多了14种元素,其原因是__。
(2)周期表中__族所含元素最多。
(3)请分析周期数与元素种类的关系,可推测出第8周期可能含有的元素种类为__(填序号)。
A.18 B.32 C.50 D.64
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素X、Y、Z、W在元素周期表中的位置如图所示,其中W原子序数是Z的2倍。下列说法不正确的是
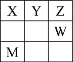
A.X、Y、Z的氢化物沸点依次升高
B.Z和W形成的化合物溶于水,既有共价键的断裂,又有共价键的形成
C.X、Y、Z与氢元素组成的化学式为XY2ZH4的物质可能是分子晶体,也可能是离子晶体
D.M的原子序号为32,是一种重要的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】朱自清先生在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影……”月光穿过薄雾所形成的种种美景的本质原因是( )
A.光是一种胶体B.雾是一种胶体
C.发生丁达尔效应D.空气中的小水滴颗粒大小约为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种元素为短周期元素,其原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族;A与B形成离子化合物,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子分子。试回答下列问题:
(1)写出五种元素名称A________,B________,C________,D________,E________;
(2)用电子式表示A2C的形成过程________________________________;
(3)D与E形成常见离子的空间构型为________________;
(4)A、B两元素形成的化合物A2B2属于__________晶体(填类型),晶体内存在的化学键有___________;A2B晶体的熔点_______(填“>”“=”“<”)A2C晶体的熔点;
(5)由A、B、C、E四种元素,可以共同形成两种不同化合物,它们的水溶液可以反应生成一种气体,请写出离子方程式:___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com