
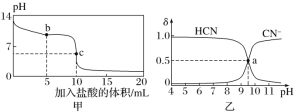
【题目】25 ℃时,向10 mL 0.01 mol·L-1 NaCN溶液中逐滴加入0.01 mol·L-1的盐酸,其pH变化曲线如下图甲所示。NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如下图乙所示[其中a点的坐标为(9.5,0.5)]。
下列溶液中的关系一定正确的是( )
A.图乙中pH=7的溶液:c(Cl-)=c(HCN)
B.常温下,NaCN的水解平衡常数:Kh(NaCN)=10-9.5
C.图甲中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D.图甲中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
【答案】A
【解析】
25℃时,NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如图甲所示,可知CN-、HCN含量相等时,溶液呈碱性,说明HCN电离程度小于CN-水解程度,向10 mL 0.01 molL-1 NaCN溶液中逐滴加入0.01 molL-1的盐酸,其pH变化曲线如图乙所示,当加入盐酸5mL时,溶液组成为NaCN、HCN,溶液呈碱性,加入盐酸10mL时,完全反应生成HCN,溶液呈酸性,以此解答该题。
A. 图甲中pH=7的溶液中c(H+)=c(OH),由溶液电荷守恒可知:c(Na+)+c(H+)=c(OH)+c(CN)+c(Cl),结合物料守恒可c(Na+)=c(HCN)+c(CN)可知:c(Cl)=c(HCN),故A正确;
B. a点的坐标为(9.5,0.5),则a点c(HCN)=c(CN),NaCN的水解平衡常数K(NaCN)= =c(OH)=10-4.5mol/L,故B错误;
=c(OH)=10-4.5mol/L,故B错误;
C. b点反应生成等浓度的NaCN、HCN,溶液呈碱性,则HCN电离程度小于CN水解程度,可知c(HCN)>c(CN),故C错误;
D. 任何电解质溶液中都存在电荷守恒和物料守恒,根据物料守恒得c(Cl)=c(HCN)+c(CN),而根据电荷守恒可知,c(Na+)+c(H+)=c(Cl)+c(OH)+c(CN),则c(Na+)+c(H+)=c(HCN)+c(OH)+2c(CN),故D错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】下列对于过氧化钠的叙述中,正确的是( )
A. 将少量Na2O2投入紫色石蕊试液中,溶液最终呈蓝色
B. 1 mol Na2O2与H2O完全反应,转移2 mol电子
C. 充分加热等物质的量的Na2O2和NaHCO3的混合物,剩余物质为Na2CO3
D. a g CO和H2的混合气体充分燃烧的产物与足量的Na2O2充分反应后,固体质量增加a g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)

(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
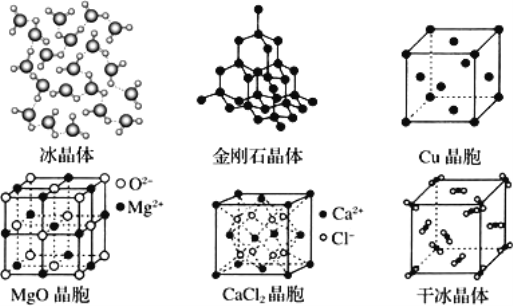
【题目】如图为几种晶体或晶胞的示意图:
请回答下列问题:
(1)a:冰、b:金刚石、c:MgO、d:CaCl2、e:干冰 5 种晶体的熔点由高到低的顺序为________
(2)金刚石晶胞中若碳原子半径为 r,根据硬球接触模型,列式表示碳原子在晶胞中的空间占有率________(计算结果为含 π 的分数,不要化为小数或百分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于盐类水解反应的说法正确的是( )
A.溶液呈中性的盐一定是强酸与强碱生成的盐
B.含有弱酸根离子的盐的水溶液一定呈碱性
C.盐溶液的酸碱性主要决定于形成盐的酸、碱电离程度的相对大小
D.Na2S水解的离子方程式为:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验原理和装置能达到实验目的的是
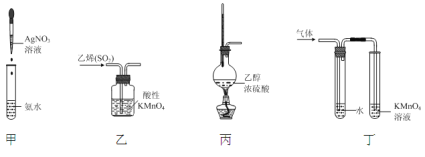
A.装置甲:制取银氨溶液B.装置乙:除去乙烯中混有的SO2
C.装置丙:制取乙烯D.装置丁:验证溴乙烷在氢氧化钠醇溶液加热条件下发生了消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
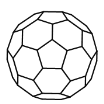
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A.0.1 mol C3H9N中所含共用电子对数目为1.2NA
B.14 g N60(分子结构如图所示)中所含N-N键数目为1.5NA
C.某温度下,1 L pH=6的纯水中所含OH数目为1.0×108 NA
D.标准状况下,5.6 L甲醛气体中所含的质子数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据部分短周期元素的信息回答问题。
元素 | 元素信息 |
| 第3周期ⅥA族 |
| 族序数是周期数的3倍 |
| 原子序数是11 |
|
|
(1)![]() 、
、![]() 的元素符号分别为______、______,
的元素符号分别为______、______,![]() 、
、![]() 的元素名称分别为______、______。
的元素名称分别为______、______。
(2)写出![]() 、
、![]() 的常见单质在加热时的反应方程式:______。
的常见单质在加热时的反应方程式:______。
(3)从原子结构的角度分析,![]() 原子与
原子与![]() 原子的______相同,
原子的______相同,![]() 原子与
原子与![]() 原子的______相同。
原子的______相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种药物合成的中间体,F的一种合成路线如下:

已知:

回答下列问题:
(1)![]() 的名称为____。
的名称为____。
(2)D中含氧官能团的名称为____。
(3)B→C的反应方程式为____。
(4)D→E的反应类型为____。
(5)C的同分异构体有多种,其中苯环上连有—ONa、2个—CH3的同分异构体还有____种,写出核磁共振氢谱为3组峰,峰面积之比为6:2:1的同分异构体的结构简式____。
(6)依他尼酸钠( )是一种高效利尿药物,参考以上合成路线中的相关信息,设计以
)是一种高效利尿药物,参考以上合成路线中的相关信息,设计以![]() 为原料(其他原料自选)合成依他尼酸钠的合成路线。________________
为原料(其他原料自选)合成依他尼酸钠的合成路线。________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com