
【题目】根据部分短周期元素的信息回答问题。
元素 | 元素信息 |
| 第3周期ⅥA族 |
| 族序数是周期数的3倍 |
| 原子序数是11 |
|
|
(1)![]() 、
、![]() 的元素符号分别为______、______,
的元素符号分别为______、______,![]() 、
、![]() 的元素名称分别为______、______。
的元素名称分别为______、______。
(2)写出![]() 、
、![]() 的常见单质在加热时的反应方程式:______。
的常见单质在加热时的反应方程式:______。
(3)从原子结构的角度分析,![]() 原子与
原子与![]() 原子的______相同,
原子的______相同,![]() 原子与
原子与![]() 原子的______相同。
原子的______相同。
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.下表是元素周期表的一部分, 回答下列问题:
a | ||||||||
b | c | d | e | |||||
f | g | h | i |
(1)d、e、f对应简单离子的半径由大到小的顺序为_______(用具体微粒符号表示)。
(2)元素i的单质溶于水,生成一种具有漂白作用的化合物,该化合物的电子式为_____;写出a与c形成的一种含18电子且既含极性键又含非极性键的化合物的分子式_________。
(3)以元素a的单质为燃料,以f的最高价氧化物对应的水化物为电解质溶液,请写出该燃料电池的负极反应方程式_________。
Ⅱ. (1)根据下列信息判断氢气燃烧生成水时的热量变化:
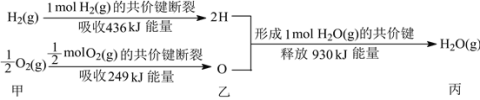
①H2(g)与O2(g)反应生成1molH2O(g)时放出的热量为________kJ;
②图中甲、乙、丙中物质所具有的总能量由大到小顺序为:________;
(2)铅蓄电池是最常见的二次电池,放电时的化学方程式为:Pb(s) + PbO2(s) + 2H2SO4(aq) = 2PbSO4(s) + 2H2O。负极反应式为__________,一段时间后,负极增重48克,转移电子_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,向10 mL 0.01 mol·L-1 NaCN溶液中逐滴加入0.01 mol·L-1的盐酸,其pH变化曲线如下图甲所示。NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如下图乙所示[其中a点的坐标为(9.5,0.5)]。
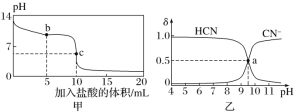
下列溶液中的关系一定正确的是( )
A.图乙中pH=7的溶液:c(Cl-)=c(HCN)
B.常温下,NaCN的水解平衡常数:Kh(NaCN)=10-9.5
C.图甲中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D.图甲中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素X、Y、Z、W在元素周期表中的位置如图所示,其中W原子序数是Z的2倍。下列说法不正确的是
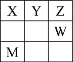
A.X、Y、Z的氢化物沸点依次升高
B.Z和W形成的化合物溶于水,既有共价键的断裂,又有共价键的形成
C.X、Y、Z与氢元素组成的化学式为XY2ZH4的物质可能是分子晶体,也可能是离子晶体
D.M的原子序号为32,是一种重要的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列问题:
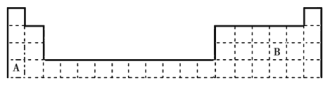
(1)B在周期表中的位置是__;写出A、B的单质之间发生反应的化学方程式:__。
(2)写出表中位于长周期的卤族元素的名称:__;属于短周期的碱金属元素的元素符号为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】朱自清先生在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影……”月光穿过薄雾所形成的种种美景的本质原因是( )
A.光是一种胶体B.雾是一种胶体
C.发生丁达尔效应D.空气中的小水滴颗粒大小约为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示①、②两个装置的叙述,正确的是( )
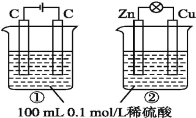
A.装置名称:①是原电池,②是电解池
B.硫酸浓度变化:①增大,②减小
C.电极反应式:①中阳极:4OH--4e-=2H2O+O2↑、②中负极:Zn-2e-=Zn2+
D.离子移动方向:①中H+向阴极方向移动,②中H+向负极方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L容器中,某一反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:

(1)在4min末时,A.B的物质的量浓度c(A)___c(B);在该温度下达到化学平衡时c(A)___c(B)(以上填“>”“<”或“=”);
(2)从反应开始至4min时,A的平均反应速率为___;
(3)该反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对加碘食盐中碘酸钾进行研究,查阅资料得知:碘酸钾是一种白色粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂与HI、H2O2等物质作用,被还原为单质碘。
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
①称取wg加碘盐,加适量蒸馏水溶解。
②用稀硫酸酸化所得的溶液,再加入过量KI溶液,写出该步反应的离子方程式:_______。
③以淀粉为指示剂,用物质的量浓度为1.00×10-3molL-1的Na2S2O3溶液滴定![]() 滴定时的反应方程式为
滴定时的反应方程式为![]() ,滴定时Na2S2O3溶液应放在 ______
,滴定时Na2S2O3溶液应放在 ______ ![]() 填“酸式滴定管”或“碱式滴定管”
填“酸式滴定管”或“碱式滴定管”![]() ,滴定至终点的现象为_______________。
,滴定至终点的现象为_______________。
(2)学生乙对纯净的NaCl(不含KIO3)进行了下列实验:
顺序 | 步骤 | 实验现象 |
① | 取少量纯净的NaCl,加适量蒸馏水溶解 | 溶液无变化 |
② | 滴入少量淀粉-KI溶液,振荡 | 溶液无变化 |
③ | 然后再滴加稀硫酸,振荡 | 溶液变蓝色 |
请推测实验③中产生蓝色现象的可能原因: __________________ ;根据学生乙的实验结果可推测学生甲的实验结果可能 ______ (填“偏大”、“偏小”或“无影响”)。
(3)学生丙设计实验证明加碘食盐样品中碘元素的存在形式是IO3-而不是I-,进行如下实验。写出实验步骤、预期现象和结论。限选试剂:稀硫酸、稀硝酸、3% H2O2溶液、新制氯水、1%淀粉溶液、蒸馏水。
实验步骤 | 预期现象和结论 |
步骤1:取少量食盐样品于试管中,加适量蒸馏水使其完全溶解, _____________________ | ______ |
步骤2:另取少量食盐样品于试管中,加适量蒸馏水使其完全溶解,滴入适量的稀硫酸酸化, _____________________ | ______ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com