
【题目】下表是元素周期表的一部分,回答下列问题:
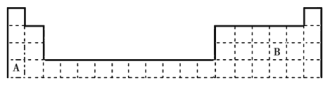
(1)B在周期表中的位置是__;写出A、B的单质之间发生反应的化学方程式:__。
(2)写出表中位于长周期的卤族元素的名称:__;属于短周期的碱金属元素的元素符号为__。
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】不能正确表示下列变化的离子方程式是
A.BaCO3溶于盐酸:BaCO3+2H+=Ba2++CO2↑+H2O
B.FeCl3溶液腐蚀铜板:2Fe3++Cu=2Fe2++Cu2+
C.碳酸氢钠溶液和过量的澄清石灰水混合:2HCO3-+ Ca2+ + 2OH-= CaCO3↓+ CO32- + 2H2O
D.醋酸钠水解:CH3COO+H2O![]() CH3COOH+OH
CH3COOH+OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于盐类水解反应的说法正确的是( )
A.溶液呈中性的盐一定是强酸与强碱生成的盐
B.含有弱酸根离子的盐的水溶液一定呈碱性
C.盐溶液的酸碱性主要决定于形成盐的酸、碱电离程度的相对大小
D.Na2S水解的离子方程式为:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
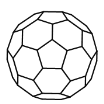
A.0.1 mol C3H9N中所含共用电子对数目为1.2NA
B.14 g N60(分子结构如图所示)中所含N-N键数目为1.5NA
C.某温度下,1 L pH=6的纯水中所含OH数目为1.0×108 NA
D.标准状况下,5.6 L甲醛气体中所含的质子数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2NO2![]() N2O4的可逆反应中,下列状态一定属于平衡状态的是( )
N2O4的可逆反应中,下列状态一定属于平衡状态的是( )
A.N2O4和NO2的分子数比为1∶2
B.N2O4和NO2的浓度相等
C.平衡体系的颜色不再改变
D.单位时间内有1 mol N2O4变为NO2的同时,有2 mol NO2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据部分短周期元素的信息回答问题。
元素 | 元素信息 |
| 第3周期ⅥA族 |
| 族序数是周期数的3倍 |
| 原子序数是11 |
|
|
(1)![]() 、
、![]() 的元素符号分别为______、______,
的元素符号分别为______、______,![]() 、
、![]() 的元素名称分别为______、______。
的元素名称分别为______、______。
(2)写出![]() 、
、![]() 的常见单质在加热时的反应方程式:______。
的常见单质在加热时的反应方程式:______。
(3)从原子结构的角度分析,![]() 原子与
原子与![]() 原子的______相同,
原子的______相同,![]() 原子与
原子与![]() 原子的______相同。
原子的______相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.如图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题。
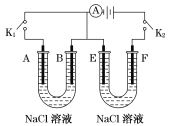
(1)断开K2,闭合K1时。B为___极,A的电极反应为_______,最终可观察到的现象是________。
(2)断开K1,闭合K2时。E为_____极,F极的电极反应为_____,检验F极产物的方法是___。
(3)若往U形管中滴加酚酞试液,进行(1)(2)操作时,A、B、E、F电极周围能变红的是____。
Ⅱ.如图所示,若电解5min时铜电极质量增加2.16g,B池的两极都有气体产生。
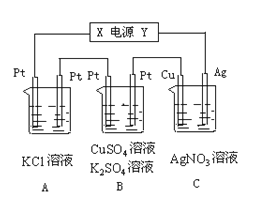
试回答:
(1)电源电极X名称为____。
(2)pH变化:A池_____, B池______, C池____。
(3)写出B池中所发生的电解反应方程式: _________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg、Ni、Cu、Zn 等元素在生产、生活中有着广泛的应用。回答下列问题:
(1)Mg、Ni、Cu 等金属可能形成金属互化物。金属互化物的结构类型丰富多样,确定某种金属互化物是晶体还是非晶体可通过___________测定。
(2)根据 Cu、Zn 的原子结构比较第一电离能:I1(Cu)_________ I1(Zn)(填“大于”、 “等于”或“小于”),理由是_____________________。
(3)[Ni(NH3)6](NO3)2 中不存在的化学键为___________(填序号)。
a.离子键 b.金属键 c.配位键 d.氢键
(4)镍基合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。
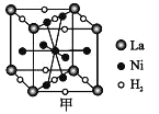
该合金储氢后,H2 与 Ni 的物质的量之比为___________。
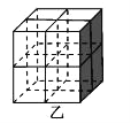
②Mg2NiH4 是一种储氢的金属氢化物。在 Mg2NiH4 晶胞中,Ni 原子占据如图乙的顶点和面心,Mg2+处于乙图八个小立方体的体心。Mg2+位于 Ni 原子形成的___________ (填“八面体空隙”或“四面体空隙”)。 晶体的密度为ρg·cm-3,NA表示阿伏加德罗常数,Mg2+和 Ni 原子的最短距离为__________cm(用含ρ和 NA 的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是( )

A.Fe2+的氧化率随时间延长而逐渐增大
B.由①和③可知,温度越高,Fe2+氧化速率越快
C.由②和③可知,pH越大,Fe2+氧化速率越快
D.氧化过程的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com