
【题目】I.如图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题。
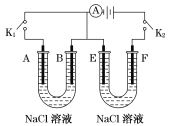
(1)断开K2,闭合K1时。B为___极,A的电极反应为_______,最终可观察到的现象是________。
(2)断开K1,闭合K2时。E为_____极,F极的电极反应为_____,检验F极产物的方法是___。
(3)若往U形管中滴加酚酞试液,进行(1)(2)操作时,A、B、E、F电极周围能变红的是____。
Ⅱ.如图所示,若电解5min时铜电极质量增加2.16g,B池的两极都有气体产生。
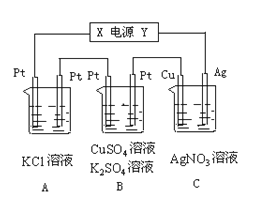
试回答:
(1)电源电极X名称为____。
(2)pH变化:A池_____, B池______, C池____。
(3)写出B池中所发生的电解反应方程式: _________。
【答案】负 O2+4e-+2H2O=4OH- 溶液中有红褐色沉淀生成 阴 2Cl--2e-=Cl2↑ 用湿润的淀粉碘化钾试纸靠近F极,试纸变蓝,证明是氯气 AE 负极 变大 变小 不变 2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,2H2O
2Cu+O2↑+2H2SO4,2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
【解析】
(1)断开K2,闭合K1时,左端U形管没有外接直流电源,则形成原电池,相对活泼的电极为负极,则B为负极,电极反应为Fe-2e- =Fe2+;A为正极,发生吸氧腐蚀,电极反应为O2+4e-+2H2O=4OH-。两电极产物反应生成Fe(OH)2,然后发生4Fe(OH)2+O2+2H2O=4Fe(OH)3,最终可观察到的现象是溶液中有红褐色沉淀生成。答案为:负;O2+4e-+2H2O=4OH-;溶液中有红褐色沉淀生成;
(2)断开K1,闭合K2时,右端U形管形成电解池,与电源正极相连的F极为阳极,则E为阴极;在F极,Cl-失电子生成Cl2,电极反应为2Cl--2e-=Cl2↑,检验F极产物Cl2,可使用湿润的淀粉碘化钾试纸,具体方法是:用湿润的淀粉碘化钾试纸靠近F极,试纸变蓝,证明是氯气。答案为:阴;2Cl--2e-=Cl2↑;用湿润的淀粉碘化钾试纸靠近F极,试纸变蓝,证明是氯气;
(3)若往U形管中滴加酚酞试液,进行(1)(2)操作时,A极反应为 O2+4e-+2H2O=4OH-,B极反应为Fe-2e- =Fe2+,E极反应为2H2O+2e-=2OH-+H2↑,F极反应为2Cl--2e-=Cl2↑,则电极周围能变红的是AE。答案为:AE;
Ⅱ.电解5min时,铜电极质量增加2.16g,则Cu电极为阴极,Ag电极为阳极,与它相连的电源Y电极为正极,X电极为负极。A池中,左端Pt电极为阴极,右端Pt电极为阳极,电池反应为2KCl+2H2O![]() 2KOH+Cl2↑+H2↑;B池中,左端Pt电极为阴极,右端Pt电极为阳极,电池反应为2CuSO4+2H2O
2KOH+Cl2↑+H2↑;B池中,左端Pt电极为阴极,右端Pt电极为阳极,电池反应为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,2H2O
2Cu+O2↑+2H2SO4,2H2O![]() 2H2↑+O2↑(B池的两极都有气体产生,所以有后一反应发生);C池中,Cu电极反应Ag++e- =Ag,Ag电极反应Ag-e- =Ag+。
2H2↑+O2↑(B池的两极都有气体产生,所以有后一反应发生);C池中,Cu电极反应Ag++e- =Ag,Ag电极反应Ag-e- =Ag+。
(1)依上面分析,电源电极X名称为负极。答案为:负极;
(2)从上面分析可知,pH变化:A池变大, B池变小, C池不变。答案为:变大;变小;不变;
(3)由分析知,B池中所发生的电解反应方程式:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,2H2O
2Cu+O2↑+2H2SO4,2H2O![]() 2H2↑+O2↑。答案为:2CuSO4+2H2O
2H2↑+O2↑。答案为:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,2H2O
2Cu+O2↑+2H2SO4,2H2O![]() 2H2↑+O2↑。
2H2↑+O2↑。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某教师设计了如图所示装置(夹持装置等已省略),其实验操作为:先按图安装好装置,关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)地通入气体,即可在M处观察到明显的实验现象。试回答以下问题:
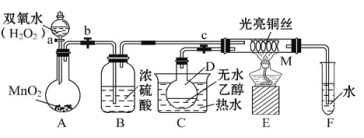
(1)B的作用:_________;C中热水的作用:__________;
(2)M处发生反应的总反应方程式为__________;
(3)从M管中可观察到的现象:______,从中可认识到该实验过程中催化剂______(填“参加”或“不参加”)化学反应。
(4)实验进行一段时间后,若撤掉酒精灯,反应仍能继续进行,则说明________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知盐酸是强酸,在下列叙述中,能说明醋酸是弱酸的是
A.将pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入水的量少
B.盐酸和醋酸都可用相应的钠盐与同浓度硫酸反应制取
C.相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH变大
D.相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列问题:
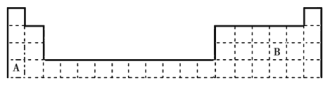
(1)B在周期表中的位置是__;写出A、B的单质之间发生反应的化学方程式:__。
(2)写出表中位于长周期的卤族元素的名称:__;属于短周期的碱金属元素的元素符号为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:①Cl2 ②SO2 ③0.1mol·L-1Na2CO3溶液中的溶质 ④0.1mol·L-1的氨水中的NH3·H2O ⑤0.1mol·L-1CH3COOH溶液中的溶质 ⑥BaSO4。
(1)属于强电解质的是_____,属于弱电解质的是_____,属于非电解质的是_______,向⑤中加入等物质的量④,溶液导电性____(填“增强”或“减弱”)。
(2)已知③溶液呈碱性,甲同学认为显碱性原因是CO32-水解所致,为证明上述观点是否正确,请设计一个简单的实验,简述实验过程。___________。
(3)在T℃时,反应2SO2(g)+O2(g)![]() 2SO3(g) △H<0的平衡常数K=6×102,则:
2SO3(g) △H<0的平衡常数K=6×102,则:
①温度升高,化学平衡移动后,平衡常数K值________(填“增大”、“减少”或“不变”)。
②T℃时,向容积为2L的密闭容器中充入0.4molSO2、0.18molO2和1.2molSO3的混合气体,此时该反应是否处于化学平衡状态____(填“是”或“否”),化学反应速率v(正)___v(逆)(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示①、②两个装置的叙述,正确的是( )
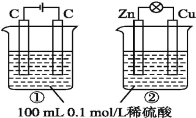
A.装置名称:①是原电池,②是电解池
B.硫酸浓度变化:①增大,②减小
C.电极反应式:①中阳极:4OH--4e-=2H2O+O2↑、②中负极:Zn-2e-=Zn2+
D.离子移动方向:①中H+向阴极方向移动,②中H+向负极方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以金属镍废料(除NiO外,还含有少量的FeO、Fe2O3) 为原料生产Ni2O3的流程如下:
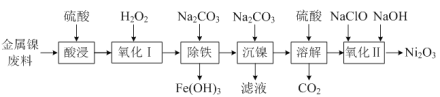
(1) “酸浸”时,Fe2O3发生反应的化学方程式为_____。
(2) “氧化Ⅰ”时,加入双氧水的目的是_____。
(3) “沉镍”时,检验Ni2+沉淀完全的操作是_____。
(4) “氧化Ⅱ”时,发生反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,①![]() 氮气②
氮气②![]() 二氧化碳③
二氧化碳③![]() ,含分子数最多的是__________(填序号,下同);质量最大的是__________;体积最小的是_________。
,含分子数最多的是__________(填序号,下同);质量最大的是__________;体积最小的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机合成中间体的结构简式如图所示。下列关于该有机物的叙述正确的是( )
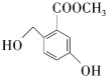
A.分子式为C9H8O4
B.1mol该物质最多能与3molBr2发生取代反应
C.在浓硫酸作用下可发生消去反应
D.在一定条件下能与金属Na发生反应,并产生1molH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com