
【题目】在标准状况下,①![]() 氮气②
氮气②![]() 二氧化碳③
二氧化碳③![]() ,含分子数最多的是__________(填序号,下同);质量最大的是__________;体积最小的是_________。
,含分子数最多的是__________(填序号,下同);质量最大的是__________;体积最小的是_________。
科目:高中化学 来源: 题型:
【题目】关于盐类水解反应的说法正确的是( )
A.溶液呈中性的盐一定是强酸与强碱生成的盐
B.含有弱酸根离子的盐的水溶液一定呈碱性
C.盐溶液的酸碱性主要决定于形成盐的酸、碱电离程度的相对大小
D.Na2S水解的离子方程式为:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.如图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题。
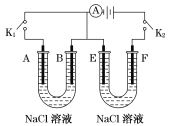
(1)断开K2,闭合K1时。B为___极,A的电极反应为_______,最终可观察到的现象是________。
(2)断开K1,闭合K2时。E为_____极,F极的电极反应为_____,检验F极产物的方法是___。
(3)若往U形管中滴加酚酞试液,进行(1)(2)操作时,A、B、E、F电极周围能变红的是____。
Ⅱ.如图所示,若电解5min时铜电极质量增加2.16g,B池的两极都有气体产生。
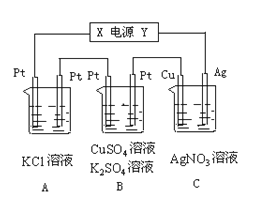
试回答:
(1)电源电极X名称为____。
(2)pH变化:A池_____, B池______, C池____。
(3)写出B池中所发生的电解反应方程式: _________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg、Ni、Cu、Zn 等元素在生产、生活中有着广泛的应用。回答下列问题:
(1)Mg、Ni、Cu 等金属可能形成金属互化物。金属互化物的结构类型丰富多样,确定某种金属互化物是晶体还是非晶体可通过___________测定。
(2)根据 Cu、Zn 的原子结构比较第一电离能:I1(Cu)_________ I1(Zn)(填“大于”、 “等于”或“小于”),理由是_____________________。
(3)[Ni(NH3)6](NO3)2 中不存在的化学键为___________(填序号)。
a.离子键 b.金属键 c.配位键 d.氢键
(4)镍基合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。
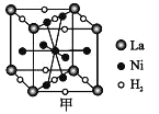
该合金储氢后,H2 与 Ni 的物质的量之比为___________。
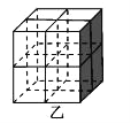
②Mg2NiH4 是一种储氢的金属氢化物。在 Mg2NiH4 晶胞中,Ni 原子占据如图乙的顶点和面心,Mg2+处于乙图八个小立方体的体心。Mg2+位于 Ni 原子形成的___________ (填“八面体空隙”或“四面体空隙”)。 晶体的密度为ρg·cm-3,NA表示阿伏加德罗常数,Mg2+和 Ni 原子的最短距离为__________cm(用含ρ和 NA 的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】布洛芬具有降温和抑制肺部炎症的双重作用。一种制备布洛芬的合成路线如下:
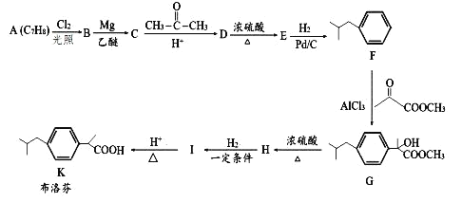
已知:①CH3CH2Cl![]() CH3CH2MgCl
CH3CH2MgCl![]()
![]()
②![]() +HCl
+HCl
回答下列问题:
(1)A 的化学名称为___________,E→F 的反应类型为___________,H 中官能团的名称为___________。
(2)分子中所有碳原子可能在同一个平面上的 E 的结构简式为___________。
(3)I→K 的化学方程式为___________。
(4)写出符合下列条件的 D 的同分异构体的结构简式___________ (不考虑立体异构)。
①能与 FeCl3 溶液发生显色反应; ②分子中有一个手性碳原子;③苯环上有处于间位的 2 个取代基。
(5)写出以间二甲苯、CH3COCl 和(CH3)2CHMgCl 为原料制备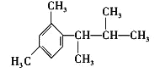 的合成路线__________ (无机试剂任选)
的合成路线__________ (无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种药物合成的中间体,F的一种合成路线如下:

已知:

回答下列问题:
(1)![]() 的名称为____。
的名称为____。
(2)D中含氧官能团的名称为____。
(3)B→C的反应方程式为____。
(4)D→E的反应类型为____。
(5)C的同分异构体有多种,其中苯环上连有—ONa、2个—CH3的同分异构体还有____种,写出核磁共振氢谱为3组峰,峰面积之比为6:2:1的同分异构体的结构简式____。
(6)依他尼酸钠( )是一种高效利尿药物,参考以上合成路线中的相关信息,设计以
)是一种高效利尿药物,参考以上合成路线中的相关信息,设计以![]() 为原料(其他原料自选)合成依他尼酸钠的合成路线。________________
为原料(其他原料自选)合成依他尼酸钠的合成路线。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组以铝铁铜合金为主要原料制备[Cu(NH3)4]SO4·H2O(一水硫酸四氨合铜)和Fe3O4胶体粒子,具体流程如下:
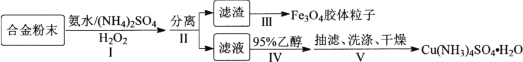
已知:①Cu(NH3)42+=Cu2++4NH3
②Fe2++2Fe3++8OH![]() Fe3O4↓+4H2O
Fe3O4↓+4H2O
③[Cu(NH3)4]SO4易溶于水,难溶于乙醇。
请回答:
(1) 滤渣的成分为________。
(2) 步骤Ⅰ中生成[Cu(NH3)4]SO4·H2O的离子方程式:________。步骤Ⅰ中加入(NH4)2SO4的作用是作为反应物和________。
(3) 步骤Ⅳ中加入95%乙醇时,缓慢加入的目的是________。
(4) 下列有关叙述正确的是________。
A 步骤Ⅰ缓慢滴加H2O2并不断搅拌,有利于提高H2O2的利用率
B 步骤Ⅳ若改为蒸发浓缩、冷却结晶,得到的一水硫酸四氨合铜晶体会含有较多Cu(OH)2等杂质
C 步骤Ⅳ、Ⅴ用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、吸滤瓶等
D 步骤Ⅴ中洗涤操作为关闭水龙头,加乙醇溶液浸没沉淀,缓慢流干,重复2~3次
(5) 步骤Ⅲ中,从滤渣制备Fe3O4胶体粒子需经过一系列操作。即:滤渣中加过量NaOH溶液搅拌溶解→________→过滤、洗涤、干燥得Fe3O4胶体粒子。
根据下列提供的操作,请在空格处填写正确的操作次序(填写序号)。
①氮气氛围下缓慢滴加NaOH溶液,加热溶液
②过滤、洗涤
③加入过量稀硫酸溶解
④加入适量FeSO4固体,搅拌溶解
⑤测定Fe3+含量
(6) 测定一水硫酸四氨合铜晶体产品的纯度,过程如下:取0.5000 g试样溶于水,滴加3 mol·L1 H2SO4至pH为3~4,加入过量KI固体。以淀粉溶液为指示剂,生成的碘用0.1000 mol·L1 Na2S2O3标准溶液滴定,重复2~3次,平均消耗Na2S2O3标准溶液20.00 mL。。该试样中一水硫酸四氨合铜的纯度为________。
已知:M[Cu(NH3)4SO4·H2O]=246.0 g·mol1; 2Cu2++4I=2CuI+I2,I2+2S2O32-=2I+S4O62-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是( )

A.Fe2+的氧化率随时间延长而逐渐增大
B.由①和③可知,温度越高,Fe2+氧化速率越快
C.由②和③可知,pH越大,Fe2+氧化速率越快
D.氧化过程的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是

A. HA是强酸
B. 该混合液pH=7
C. 图中x表示HA,Y表示OH-,Z表示H+
D. 该混合溶液中:c(A-)+c(Y)=c(Na+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com