
【题目】某有机合成中间体的结构简式如图所示。下列关于该有机物的叙述正确的是( )
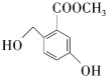
A.分子式为C9H8O4
B.1mol该物质最多能与3molBr2发生取代反应
C.在浓硫酸作用下可发生消去反应
D.在一定条件下能与金属Na发生反应,并产生1molH2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】I.如图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题。
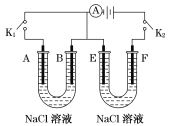
(1)断开K2,闭合K1时。B为___极,A的电极反应为_______,最终可观察到的现象是________。
(2)断开K1,闭合K2时。E为_____极,F极的电极反应为_____,检验F极产物的方法是___。
(3)若往U形管中滴加酚酞试液,进行(1)(2)操作时,A、B、E、F电极周围能变红的是____。
Ⅱ.如图所示,若电解5min时铜电极质量增加2.16g,B池的两极都有气体产生。
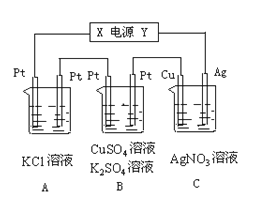
试回答:
(1)电源电极X名称为____。
(2)pH变化:A池_____, B池______, C池____。
(3)写出B池中所发生的电解反应方程式: _________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组以铝铁铜合金为主要原料制备[Cu(NH3)4]SO4·H2O(一水硫酸四氨合铜)和Fe3O4胶体粒子,具体流程如下:
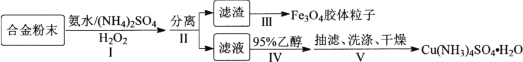
已知:①Cu(NH3)42+=Cu2++4NH3
②Fe2++2Fe3++8OH![]() Fe3O4↓+4H2O
Fe3O4↓+4H2O
③[Cu(NH3)4]SO4易溶于水,难溶于乙醇。
请回答:
(1) 滤渣的成分为________。
(2) 步骤Ⅰ中生成[Cu(NH3)4]SO4·H2O的离子方程式:________。步骤Ⅰ中加入(NH4)2SO4的作用是作为反应物和________。
(3) 步骤Ⅳ中加入95%乙醇时,缓慢加入的目的是________。
(4) 下列有关叙述正确的是________。
A 步骤Ⅰ缓慢滴加H2O2并不断搅拌,有利于提高H2O2的利用率
B 步骤Ⅳ若改为蒸发浓缩、冷却结晶,得到的一水硫酸四氨合铜晶体会含有较多Cu(OH)2等杂质
C 步骤Ⅳ、Ⅴ用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、吸滤瓶等
D 步骤Ⅴ中洗涤操作为关闭水龙头,加乙醇溶液浸没沉淀,缓慢流干,重复2~3次
(5) 步骤Ⅲ中,从滤渣制备Fe3O4胶体粒子需经过一系列操作。即:滤渣中加过量NaOH溶液搅拌溶解→________→过滤、洗涤、干燥得Fe3O4胶体粒子。
根据下列提供的操作,请在空格处填写正确的操作次序(填写序号)。
①氮气氛围下缓慢滴加NaOH溶液,加热溶液
②过滤、洗涤
③加入过量稀硫酸溶解
④加入适量FeSO4固体,搅拌溶解
⑤测定Fe3+含量
(6) 测定一水硫酸四氨合铜晶体产品的纯度,过程如下:取0.5000 g试样溶于水,滴加3 mol·L1 H2SO4至pH为3~4,加入过量KI固体。以淀粉溶液为指示剂,生成的碘用0.1000 mol·L1 Na2S2O3标准溶液滴定,重复2~3次,平均消耗Na2S2O3标准溶液20.00 mL。。该试样中一水硫酸四氨合铜的纯度为________。
已知:M[Cu(NH3)4SO4·H2O]=246.0 g·mol1; 2Cu2++4I=2CuI+I2,I2+2S2O32-=2I+S4O62-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是( )

A.Fe2+的氧化率随时间延长而逐渐增大
B.由①和③可知,温度越高,Fe2+氧化速率越快
C.由②和③可知,pH越大,Fe2+氧化速率越快
D.氧化过程的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“速力菲”是一种人工合成的补铁剂,某研究性学习小组为探究其主要成分,进行了如下实验:
(Ⅰ)打开这种药片的密封膜,发现其外观为淡黄色;
(Ⅱ)将“速力菲”投入小试管中,加入少量蒸馏水,充分振荡后发现溶液变浑浊;慢慢加入稀硫酸后溶液变得澄清透明并显黄色;滴加KSCN溶液,立即变为血红色.学生甲由此断定“速力菲”的主要成分是三价铁盐;
(Ⅲ)学生乙的操作与甲大致相同,所不同的是他动作敏捷,且在振荡前用橡皮塞塞紧试管口.结果发现:溶液仅显示淡红色.乙同学认为“速力菲”的主要成分不是三价铁盐而是亚铁盐.
(Ⅳ)为了确认甲、乙的结论是否正确,学生丙将乙所得的淡红色溶液分成两份继续进行实验:
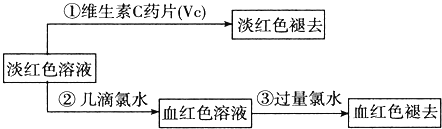
试回答下列问题:
(1)甲、乙两位同学的结论中比较合理的是 ______ ,另一同学判断出错的原因是 ______ .
(2)丙的实验①说明维生素C具有较强的 ______ 性![]() 填“氧化”或“还原”
填“氧化”或“还原”![]() .
.
(3)写出与丙的实验②中现象对应的离子反应方程式 ______;______ .
(4)关于丙的实验③中的现象,丙同学提出了两种假设:一种是过量的氯水与Fe3+结合生成了某种稳定的新物质;另一种则是过量的氯水将SCN-氧化了.请你设计一个实验方案以确认哪种假设更合理 ______ .
(5)针对实验目的,本次实验尚未完成的任务是 ______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )
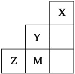
A.电负性:Z>M>Y
B.离子半径:M->Z2->Y-
C.ZM2分子中各原子的最外层均满足8电子稳定结构
D.Z元素基态原子最外层电子轨道表示式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期律可以指导人们进行规律性的推测和判断。下列说法错误的是( )
A.由水溶液的酸性:![]() 可推断出元素的非金属性:
可推断出元素的非金属性:![]()
B.若![]() 和
和![]() 的核外电子排布相同,则原子序数:
的核外电子排布相同,则原子序数:![]()
C.已知第ⅡA族元素的硫酸盐溶解性:![]() 易溶于水,
易溶于水,![]() 微溶于水,可推断出
微溶于水,可推断出![]() 难溶于水,但相同温度下
难溶于水,但相同温度下![]() 溶解度比
溶解度比![]() 的大
的大
D.![]() 和
和![]() 分别位于第六周期第ⅠA族和第ⅡA族,碱性:
分别位于第六周期第ⅠA族和第ⅡA族,碱性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是

A. HA是强酸
B. 该混合液pH=7
C. 图中x表示HA,Y表示OH-,Z表示H+
D. 该混合溶液中:c(A-)+c(Y)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于周期表的说法正确的是( )
A.C和Si属于第ⅣA族元素,SiH4比CH4稳定
B.N和B属于第二周期元素,原子半径:N>B
C.S和Cl属于第三周期元素,其含氧酸的酸性:H2SO4<HClO3
D.某元素氢化物的化学式为RH3,则其最高价氧化物的水化物可能为HRO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com