
【题目】氯及其化合物的用途广泛,例如:“84”消毒液的有效成分是次氯酸钠,漂白精的有效成分是次氯酸钙,洁厕剂的有效成分是盐酸。已知酸性: H2CO3>HClO>HCO3-。下列有关说法正确的( )
A. “84”消毒液与洁厕剂混合使用,能增强漂白或去污效果
B. 工业上制取漂白粉往往是向澄清石灰水中通入足量氯气
C. 可设计实验装置,用电解饱和食盐水的方法制备次氯酸钠溶液
D. 向“84”消毒液中通入少量CO2,反应的化学方程式为2NaClO+CO2+H2O==Na2CO3+2HClO
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】化合物H是一种用于合成γ-分泌调节剂的药物中间体,其合成路线流程图如下:

(1)C中的含氧官能团名称为_______和__________。
(2)D→E 的反应类型为__________________________。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式:_____________________。 ①含有苯环,且分子中有一个手性碳原子;②能发生水解反应,水解产物之一是α-氨基酸,另一水解产物分子中只有2种不同化学环境的氢。
(4)G 的分子式为C12H14N2O2 ,经氧化得到H,写出G的结构简式:__________________。
(5)已知: ![]() (R代表烃基,R'代表烃基或H) 请写出以
(R代表烃基,R'代表烃基或H) 请写出以![]() 和(CH3)2SO4为原料制备
和(CH3)2SO4为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) __________________。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率速率受多种因素影响,实验测得70℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法不正确的是( )
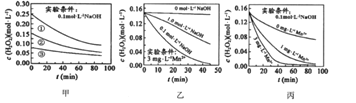
A. 图甲表明,其他条件相同时,![]() 浓度越大,其分解速率越快
浓度越大,其分解速率越快
B. 图甲![]() 和图乙因起始浓度不同不能比较
和图乙因起始浓度不同不能比较![]() 存在对化学反应速率的影响
存在对化学反应速率的影响
C. 图丙表明,![]() 作催化剂时,浓度越大催化
作催化剂时,浓度越大催化![]() 分解效果越好
分解效果越好
D. 图乙和图丙表明,相同条件下对![]() 分解速率受
分解速率受![]() 影响大
影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(CH3COOOH)是无色透明液体,易溶于水、易挥发,见光易分解,具有强氧化性的高效消毒剂,使用过氧乙酸消毒剂时通常先用水稀释工业品过氧乙酸,然后用喷雾法对空气与地面进行消毒。
(1)某学生在实验室用密度为1.15g/mL,质量分数为15%的工业品过氧乙酸配制0.1mol/L过氧乙酸溶液250mL,该生用量筒量取工业品过氧乙酸体积___________________ mL,除量筒、玻璃棒、烧杯外还需要的其它仪器是__________________________________________________________________________。
(2)该学生配制前设计了下列操作,其合理的操作顺序是___________________________________________(字母表示,每个字母只能用一次)。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需体积的工业品过氧乙酸,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的工业品过氧乙酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,倒置并振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)若出现如下情况,对所配溶液浓度将有何影响(选填“偏高” 、“ 偏低”或“无影响”)?
a. 容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水_____________________;
b. 转移溶液时,不慎有少量溶液洒在容量瓶外___________________________;
c.量取15%的工业品过氧乙酸时,仰视量筒___________________________________;
d.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,补充几滴水至刻度线____________。
(4)下列叙述正确的是__________________(填字母)。
A.可用过滤的方法将过氧乙酸溶液中混有的NaCl除掉
B.过氧乙酸包装上应贴的危险警告标签应如右图所示
C.过氧乙酸应注意密闭、低温保存于棕色细口瓶中
D.过氧乙酸是一种有机物,它可以用于萃取碘水中的碘单质
(5)过氧乙酸半小时内会完全分解成乙酸(CH3COOH)和一种常见的气体单质,检验该气体单质的实验方法是_________________________________________________________________________________________。
(6)如果生产过氧乙酸的原料CH3COONa中混有了SO42-,要想除掉SO42-请选择下列试剂按照加入先后顺序填空_________________________(试剂不必选完,填序号)。
①盐酸②醋酸钡溶液③氯化钡溶液④醋酸⑤碳酸钠溶液⑥碳酸氢钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
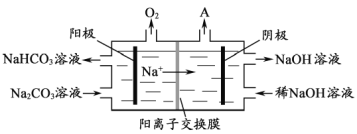
【题目】铝是应用广泛的金属。以铝土矿 (主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如图:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)Al的原子结构示意图为_________;Al与NaOH溶液反应的离子方程式为________。
(2)“碱溶”时生成偏铝酸钠的离子方程式为_______________。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_________,阴极产生的物质A的化学式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
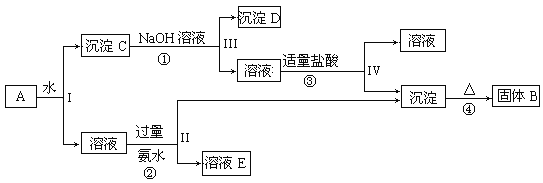
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是___________。
(2)写出①、②、③离子方程式④化学反应方程式
①____________________________;②___________________________;
③____________________________;④____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用200 mL 1 mol/L 氯化铝溶液与一定量 3 mol/L的氢氧化钠溶液混合,可得到氢氧化铝7.8g,请计算需要此氢氧化钠溶液的体积为多少毫升?(写计算步骤)________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是单质,其中A是金属,各种物质间的转化关系如图。根据图示转化关系回答:

(1)写出下列物质的化学式。
A________,B________,甲_________,乙________。
(2)写出下列变化的化学方程式。
①A与NaOH溶液反应的化学方程式________________________________。
②甲与NaOH溶液反应的离子方程式________________________________。
(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36 L,则消耗的A的物质的量为________,转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)某液体化合物X2Y4,常用做火箭燃料。16g X2Y4在一定量的O2中恰好完全燃烧,反应方程式为X2Y4(l)+O2(g)==X2(g)+2Y2O(l)。冷却后标准状况下测得生成物的体积为11.2 L,其密度为1.25 g·L-1,则:
①反应前O2的体积V(O2)为________。
②X2的摩尔质量为________________。
③Y元素的名称是________________。
(2)取1.43 g Na2CO3·xH2O溶于水配成50mL溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,共消耗盐酸20.0mL,并收集到112mLCO2(标准状况下)。
①稀盐酸物质的量浓度为________________mol·L-1
②Na2CO3·xH2O的摩尔质量为__________ g·mol-1
③x=________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com