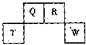
��2012?������һģ��������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ����ͼ��ʾ������T��������������������������ȣ���ش��������⣺
��1��T�����ӽṹʾ��ͼΪ
��
��2��Ԫ�صķǽ�����Ϊ��ԭ�ӵĵõ�����������Q
����
����
W���ǿ�ڡ������ڡ�����
��3��W�ĵ�����������������ˮ����Ũ��Һ�����ܷ�����Ӧ�������������ʣ�����һ�������壬��Ӧ�Ļ�ѧ����ʽΪ
��
��4��ԭ��������R��1��Ԫ�ص�һ���⻯���ֽܷ�Ϊ������һ���⻯��˷ֽⷴӦ�Ļ�ѧ����ʽ��
��
��5��R�ж�����������м���Է���������С����һ�������£�2L�ļ�������0.5L���������ϣ����û�����屻������NaOH��Һ��ȫ���պ�û����������������ɵ�R�ĺ������εĻ�ѧʽ��
NaNO2
NaNO2
I���ס���Ԫ�صĵ��ʺͻ�����Ӧ�ù㷺��
��1����Ԫ�ص�ԭ�Ӻ�������Ų�ʽ��
1s22s22p63s23p3
1s22s22p63s23p3
��
��2��������뽹̿��ʯӢɰ��ϣ��ڵ�¯�м��ȵ�1500�����ɰ��ף���ӦΪ��
2Ca
3��PO
4��
2+6SiO
2��6CaSiO
3+P
4O
10 10C+P
4O
10��P
4+10CO
ÿ����1mol P
4ʱ������
20
20
mol���ӷ���ת�ƣ�
II��ϡ��Ԫ���DZ����ս����Դ���ҹ����̲�����������λ��
��1���棨Ce���ǵؿ��к�����ߵ�ϡ��Ԫ�أ��ڼ���������CeCl
3����ˮ�⣬��ˮCeCl
3���ü���CeCl
3?6H
2O��NH
4Cl��������ķ������Ʊ�������NH
4Cl��������
�ֽ��HCl���壬����CeCl3��ˮ��
�ֽ��HCl���壬����CeCl3��ˮ��
��
��2����ijǿ���Ի��ϡ����Һ�м���H
2O
2������pH��3��Ce
3+ͨ�����з�Ӧ�γ�Ce��OH��
4�������Է��룮��ɷ�Ӧ�����ӷ���ʽ��
2
2
Ce
3++
1
1
H
2O
2+
6
6
H
2O��
2
2
Ce��OH��
4��+
6H+
6H+
����Һ�У���ӦA+2B?C�ֱ������ֲ�ͬʵ�������½��У����ǵ���ʼŨ�Ⱦ�Ϊc��A��=0.100mol/L��c��B��=0.200mol/L��c��C��=0mol/L��
��Ӧ��A��Ũ����ʱ��ı仯��ͼ��ʾ��
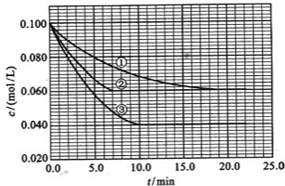
��ش��������⣺
��3����ٱȽϣ��ں͢۷ֱ���ı�һ�ַ�Ӧ���������ı���������жϵ������ǣ���
�Ӵ���
�Ӵ���
��
�ﵽƽ���ʱ�����̣�ƽ��ʱA��Ũ��δ��
�ﵽƽ���ʱ�����̣�ƽ��ʱA��Ũ��δ��
��
��
�¶�����
�¶�����
��
�ﵽƽ���ʱ�����̣�ƽ��ʱA��Ũ�ȼ�С
�ﵽƽ���ʱ�����̣�ƽ��ʱA��Ũ�ȼ�С
��
��4��ʵ���ƽ��ʱB��ת����Ϊ
40%
40%
��ʵ���ƽ��ʱC��Ũ��Ϊ
0.06mol/L
0.06mol/L
��
��5���÷�Ӧ��
����
����
�ȷ�Ӧ���ж���������
�¶����ߣ�ƽ��������Ӧ�����ƶ�
�¶����ߣ�ƽ��������Ӧ�����ƶ�
��
��6���÷�Ӧ���е�4.0minʱ��ƽ����Ӧ�ٶ��ʣ�
ʵ��ڣ�V
B=
0.014mol��L?min��-1
0.014mol��L?min��-1
��



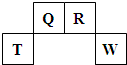 ��2009?������������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ����ͼ��ʾ������T��������������������������ȣ�
��2009?������������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ����ͼ��ʾ������T��������������������������ȣ�

 ������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ������ͼ��ʾ������Ԫ��T��������������������������ȣ���ش��������⣺
������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ������ͼ��ʾ������Ԫ��T��������������������������ȣ���ش��������⣺

 ��2012?������һģ��������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ����ͼ��ʾ������T��������������������������ȣ���ش��������⣺
��2012?������һģ��������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ����ͼ��ʾ������T��������������������������ȣ���ش��������⣺

