
【题目】Al3+与HCO3-不能大量共存是它们相互促进水解完全造成的么?__________
【答案】是
【解析】
Al3+水解消耗OH-,HCO3-水解消耗H+,结合溶液的酸碱性及离子浓度变化分析。
Al3+是强酸盐电离产生,Al3+会发生水解反应,消耗水电离产生的OH-,水解方程式为:Al3++3H2O![]() Al(OH)3+3H+,水解产生H+,使溶液显酸性;
Al(OH)3+3H+,水解产生H+,使溶液显酸性;
HCO3-是强碱盐电离产生,HCO3-会发生水解反应,消耗水电离产生的H+产生H2CO3、OH-,水解方程式为:HCO3-+H2O![]() H2CO3+OH-,水解产生OH-,使溶液显碱性;二者在同一溶液中,水解产生的H+、OH-发生中和反应,使两种离子的水解程度都增大,最终产生Al(OH)3沉淀和CO2气体,反应方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑,可见二者由于盐的双水解反应而不能大量共存。
H2CO3+OH-,水解产生OH-,使溶液显碱性;二者在同一溶液中,水解产生的H+、OH-发生中和反应,使两种离子的水解程度都增大,最终产生Al(OH)3沉淀和CO2气体,反应方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑,可见二者由于盐的双水解反应而不能大量共存。


科目:高中化学 来源: 题型:
【题目】新能源汽车的大力推广,带动锂电池材料的发展。我国科学家研发出利用钛铁矿(主要成分为![]() ,还含有少量
,还含有少量![]() 、
、![]() 、
、![]() 等杂质)制备锂离子电极材料—
等杂质)制备锂离子电极材料—![]() 和
和![]() 的工艺流程如下:
的工艺流程如下:
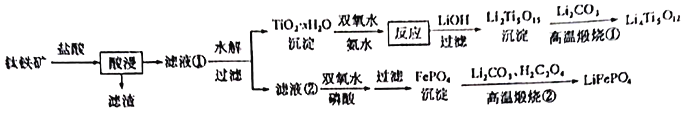
回答下列问题:
(1)![]() 中,Fe元素的化合价为____________。
中,Fe元素的化合价为____________。
(2)“酸浸”后,钛主要以![]() 形式存在,写出
形式存在,写出![]() 水解的的离子方程式_________________。
水解的的离子方程式_________________。
(3)![]() 沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
| 92 | 95 | 97 | 93 | 88 |
分析高于40℃时![]() 转化率下降的原因_______________。
转化率下降的原因_______________。
(4)![]() 中Ti的化合价为
中Ti的化合价为![]() ,其中过氧键的数目为_____________。
,其中过氧键的数目为_____________。
(5)滤液②中加入双氧水和磷酸,反应生成![]() 的离子方程式为____________;若测得Fe3+沉淀完全后,溶液中
的离子方程式为____________;若测得Fe3+沉淀完全后,溶液中![]() 为
为![]() ,则常温下溶液的pH=______________。(已知
,则常温下溶液的pH=______________。(已知![]() 的
的![]() )
)
(6)从滤液②中得到![]() 沉淀之后,要对其进行洗涤、干燥,检验沉淀已经洗涤干净的方法_________________________________________。
沉淀之后,要对其进行洗涤、干燥,检验沉淀已经洗涤干净的方法_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:X(g)+3Y(g)![]() 2Z(g),有关下列图像的说法错误的是
2Z(g),有关下列图像的说法错误的是
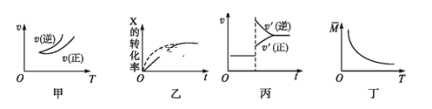
A.依据图甲可判断正反应为放热反应
B.在图乙中,虚线可表示使用了催化剂
C.若正反应的ΔH<0,图丙可表示升高温度使平衡向逆反应方向移动
D.由图丁中气体平均相对分子质量随温度的变化情况,可推知正反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在玻璃生产中,熔炉里原料发生的主要反应为:2Na2CO3+CaCO3+3SiO2![]() 2Na2SiO3+CaSiO3+3CO2↑。
2Na2SiO3+CaSiO3+3CO2↑。
(1)某反应物在熔融状态下不导电,它属于______晶体。
(2)上述反应里所涉及的短周期元素原子半径由大到小的顺序为________。
(3)碳和硅属于同族元素,该族元素的原子最外层电子的价层电子表示式为________。
(4)写一个能比较碳元素和氧元素非金属性强弱的化学反应方程式:________。
(5)CO2的电子式为_______。
(6)反应物Na2CO3与CaCO3均能制备二氧化碳,但是往往不是都能使用稀硫酸,请说明理由。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是生产化肥、硝酸等的重要原料,合成塔中每生产lmolNH3,放出46.2kJ热量。
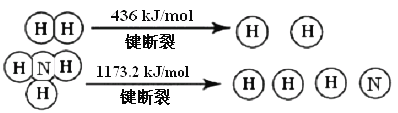
工业上合成氨的热化学方程式是___,断裂1molN![]() N键需要能量__kJ。
N键需要能量__kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予锂离子电池的发明者,LiFePO4是锂离子电池的正极材料。用含锂废渣(主要金属元素的含量:Li 8.50%、Ni 6.55%、Mg 13.24%)制备Li2C2O4,并用其制备LiFePO4部分工艺流程如图(该流程可能造成水体砷污染):
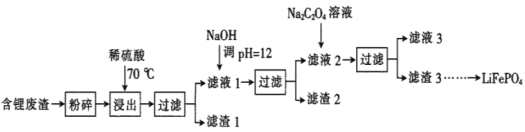
已知:滤液1、滤液2中部分离子的浓度(g·L-1):
Li+ | Ni2+ | Mg2+ | |
滤液1 | 22.72 | 20.68 | 60.18 |
滤液2 | 21.94 | 7.7×10-3 | 0.78×10-3 |
I.制备Li2C2O4
(1)滤渣2的主要成分有__(填化学式)。
(2)Na2C2O4溶液中各离子的浓度由大到小顺序为__。
(3)写出加入Na2C2O4溶液时发生反应的离子方程式:__。
Ⅱ.制备LiFePO4
(4)将电池极Li2C2O4和FePO4置于高温下反应生成LiFePO4和一种温室气体,该反应的化学方程式是___。
(5)LiFePO4需要在高温下成型后才能作为电极,高温成型时要加入少量石墨,则石墨的作用是__(任写一点)。
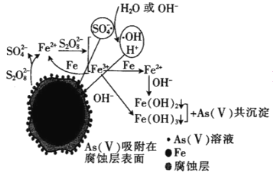
(6)我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的As(Ⅴ),其机制模型如图,其中零价铁与过硫酸钠反应的离子方程式是__。在该模型中得到的铁砷共沉淀物经灼烧(无元素化合价变化)后得到一种磁性化合物,化学式为Fe7As2O14,该物质中二价铁与三价铁的个数比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】混合溶液中离子浓度大小比较(一般情况弱电解质的电离程度约为百分之一,而盐类水解程度约为千分之一)
(1)等物质的量的NH3·H2O和NH4Cl的混合溶液中存在的水解平衡是____,存在的电离平衡是____(不写水的电离平衡),由于NH3·H2O的电离程度_____NH4Cl的水解程度,故溶液显____性。溶液中离子浓度大小关系是_________。
(2)等物质的量的CH3COOH和CH3COONa的混合溶液中存在的水解平衡是____,存在的电离平衡是_______(不写水的电离平衡),由于CH3COOH的电离程度_____CH3COONa的水解程度,故溶液显____性。溶液中离子浓度大小关系是_________。
(3)等物质的量的HCN和NaCN的混合溶液中存在的水解平衡是___,存在的电离平衡是___(不写水的电离平衡),由于HCN的电离程度_____NaCN的水解程度,故溶液显____性。溶液中离子浓度大小关系是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列有机物的结构简式。
(1)3,4二甲基3乙基庚烷___________________________。
(2)3乙基2辛烯___________________________。
(3)对甲基苯乙烯___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】左乙拉西坦(物质G)是一种治疗癫痫的药物,可通过以下方法合成:

(1)B中的含氧官能团名称为_______。
(2)E→F的反应类型为_________。
(3)X的分子式为C4H7ON,写出X的结构简式:____________。
(4)写出同时满足下列条件的G的一种同分异构体的结构简式:________。
① 能发生水解反应,水解产物仅有一种,且为α-氨基酸;
② 分子中含六元环结构,且有4种不同化学环境的氢。
(5)请以![]() 和
和![]() 为原料制备
为原料制备 ,写出相应的合成路线流程图________ [合成须使用试剂HAl(t-Bu)2,无机试剂任用,合成路线流程图示例见本题题干]。
,写出相应的合成路线流程图________ [合成须使用试剂HAl(t-Bu)2,无机试剂任用,合成路线流程图示例见本题题干]。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com