
【题目】新能源汽车的大力推广,带动锂电池材料的发展。我国科学家研发出利用钛铁矿(主要成分为![]() ,还含有少量
,还含有少量![]() 、
、![]() 、
、![]() 等杂质)制备锂离子电极材料—
等杂质)制备锂离子电极材料—![]() 和
和![]() 的工艺流程如下:
的工艺流程如下:
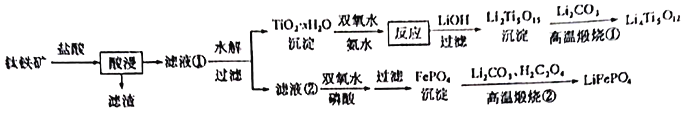
回答下列问题:
(1)![]() 中,Fe元素的化合价为____________。
中,Fe元素的化合价为____________。
(2)“酸浸”后,钛主要以![]() 形式存在,写出
形式存在,写出![]() 水解的的离子方程式_________________。
水解的的离子方程式_________________。
(3)![]() 沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
| 92 | 95 | 97 | 93 | 88 |
分析高于40℃时![]() 转化率下降的原因_______________。
转化率下降的原因_______________。
(4)![]() 中Ti的化合价为
中Ti的化合价为![]() ,其中过氧键的数目为_____________。
,其中过氧键的数目为_____________。
(5)滤液②中加入双氧水和磷酸,反应生成![]() 的离子方程式为____________;若测得Fe3+沉淀完全后,溶液中
的离子方程式为____________;若测得Fe3+沉淀完全后,溶液中![]() 为
为![]() ,则常温下溶液的pH=______________。(已知
,则常温下溶液的pH=______________。(已知![]() 的
的![]() )
)
(6)从滤液②中得到![]() 沉淀之后,要对其进行洗涤、干燥,检验沉淀已经洗涤干净的方法_________________________________________。
沉淀之后,要对其进行洗涤、干燥,检验沉淀已经洗涤干净的方法_________________________________________。
【答案】![]()
![]() 温度过高过氧化氢分解、氦水易挥发 4
温度过高过氧化氢分解、氦水易挥发 4 ![]() 3 取最后一次洗涤液少许于试管中,加入硝酸酸化的硝酸银溶液,若无白色沉淀产生,说明已经洗涤干净
3 取最后一次洗涤液少许于试管中,加入硝酸酸化的硝酸银溶液,若无白色沉淀产生,说明已经洗涤干净
【解析】
钛铁矿主要成分为![]() ,还含有少量
,还含有少量![]() 、
、![]() 、
、![]() 等杂质,加盐酸后
等杂质,加盐酸后![]() 不溶解,被过滤掉,钛主要以
不溶解,被过滤掉,钛主要以![]() 形式存在,
形式存在,![]() 、
、![]() 变成Mg2+、Ca2+,Fe2+得滤液①,水解得滤液②中含有Fe2+ 、Mg2+、Ca2+和大量的Cl-,在酸性条件下,Fe2+被双氧水氧化,得到
变成Mg2+、Ca2+,Fe2+得滤液①,水解得滤液②中含有Fe2+ 、Mg2+、Ca2+和大量的Cl-,在酸性条件下,Fe2+被双氧水氧化,得到![]() 。以此进行解答。
。以此进行解答。
(1)根据化学式中元素化合价代数和为零计算![]() 中,Fe元素的化合价为+2价,答案:+2;
中,Fe元素的化合价为+2价,答案:+2;
(2)“酸浸”后,钛主要以![]() 形式存在,
形式存在, ![]() 能发生水解,的的离子方程式
能发生水解,的的离子方程式![]() 。答案:
。答案:![]() ;
;
(3)低于40°C,![]() 转化反应转化率随温度升高而增加;超过40C双氧水分解与氨气逸出导致
转化反应转化率随温度升高而增加;超过40C双氧水分解与氨气逸出导致![]() 转化反应转化率下降;答案:温度过高过氧化氢分解、氨水易挥发。
转化反应转化率下降;答案:温度过高过氧化氢分解、氨水易挥发。
(4)![]() 中Ti的化合价为
中Ti的化合价为![]() ,Li为+1价,所以正化合价总和为22价,设表现-1价的氧原子为x个,表现-2价的氧原子为y个,根据化学式中元素化合价代数和为零x+2y=22;x+y=15,解得x=8,y=7,所以过氧键的数目为4,答案:4。
,Li为+1价,所以正化合价总和为22价,设表现-1价的氧原子为x个,表现-2价的氧原子为y个,根据化学式中元素化合价代数和为零x+2y=22;x+y=15,解得x=8,y=7,所以过氧键的数目为4,答案:4。
(5)滤液②中含有Fe2+,在酸性条件下,被双氧水氧化成Fe3+,和磷酸根结合成![]() 沉淀,其反应的离子方程式为
沉淀,其反应的离子方程式为![]() ;若测得Fe3+沉淀完全后,溶液中
;若测得Fe3+沉淀完全后,溶液中![]() 为
为![]() ,根据沉淀溶解平衡原理可知:c3(OH-)=
,根据沉淀溶解平衡原理可知:c3(OH-)=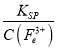 =
=![]() =10-33,c(OH-)=10-11 mol/L,c(H+)=10-3mol/L, 则常温下溶液的pH=3;答案:
=10-33,c(OH-)=10-11 mol/L,c(H+)=10-3mol/L, 则常温下溶液的pH=3;答案:![]() ;3;
;3;
(6)因为滤液②中含有大量的Cl-,遇到硝酸酸化的硝酸银溶液会有白色沉淀产生,所以得到![]() 沉淀之后,要对其进行洗涤、干燥,检验沉淀已经洗涤干净的方法:取最后一次洗涤液少许于试管中,加入硝酸酸化的硝酸银溶液,若无白色沉淀产生,说明已经洗涤干净。答案:取最后一次洗涤液少许于试管中,加入硝酸酸化的硝酸银溶液,若无白色沉淀产生,说明已经洗涤干净。
沉淀之后,要对其进行洗涤、干燥,检验沉淀已经洗涤干净的方法:取最后一次洗涤液少许于试管中,加入硝酸酸化的硝酸银溶液,若无白色沉淀产生,说明已经洗涤干净。答案:取最后一次洗涤液少许于试管中,加入硝酸酸化的硝酸银溶液,若无白色沉淀产生,说明已经洗涤干净。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】周期表中前四周期的元素A、B、C、D,原子序数依次增大,且A、B、C同周期。A共有两个原子轨道上有电子,且电子数目相同。B、C相邻,且C中的未成对电子数为3个,D是人类最早使用的元素,并以这种元素命名了一个时代。请回答下面的问题:
(1)A、B、C第一电离能从小到大的顺序为:__________________(填元素符号),D的价层电子排布图为:_______________________。
(2)在不同的温度下,A以ACl2和二聚体 A2Cl4两种形式存在,二聚体的结构式如下图所示:
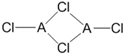
①ACl2中A的杂化方式为_____________。
②1mol A2Cl4中含配位键的数目为_____________。
(3)B元素能形成多种同素异形体,其中一种同素异形体X的晶体结构和晶胞结构如图所示。已知X的密度是a g/cm3,B-B键的键长为r cm,阿伏加德罗常数的值为NA。
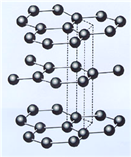
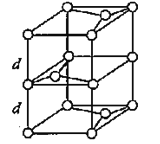
X的晶体结构(左)和晶胞(右)
①X中含有的化学键为____________________。
②X晶体的层间距离为___________________。
(4)C元素可以形成两种含氧酸HCO2和HCO3,酸性是HCO3___HCO2(填“强于”或者“弱于”),原因为__________________________。
(5)将二维密置层在三维空间内堆积,可以得到两种金属晶体的最密堆积方式。一种是按照XYXYXYXY……方式堆积,我们称这种堆积方式为“甲”方式。另外一种是按照XYZXYZXYZXYZ……方式堆积,我们称这种堆积方式为“乙”方式。则金属D的堆积方式为_______。(填“甲”或“乙”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.2mol·L-1H2A溶液中滴加0.2mol.L-1NaOH溶液,溶液中微粒H2A、HA-、A2-的物质的量的变化曲线如图所示。下列说法错误的是
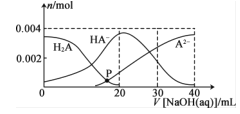
A.当V[NaOH(aq)]=20 mL时.c(OH- )=c(H+ )+c(HA- )+2c(H2A)
B.在P点时,c(Na+ )+c(H+ )=c(OH- )+c(HA- ) +c(A2- )+c(H2A)
C.当V[NaOH(aq)]=30 mL时,2c(Na+ )=3[c(HA- )+c(A2- )+c(H2A)]
D.当V[NaOH(aq)]=40 mL.时.c(Na+ )>c(A2- )>c(OH- )>c(HA- )>c(H2A)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示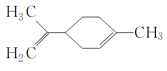 ,下列有关该有机物的说法正确的是( )
,下列有关该有机物的说法正确的是( )
A.该有机物的化学式为C10H14
B.它的一氯代物有6种
C.该有机物分子中所有的碳原子一定在同一平面上
D.一定条件下,它可以发生取代、加成、氧化和还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物W可用作高分子膨胀剂,一种合成路线如下:

回答下列问题:
(1)A的化学名称为________。
(2)②的反应类型是__________。
(3)反应④所需试剂,条件分别为________。
(4)G的分子式为________。
(5)W中含氧官能团的名称是____________。
(6)写出与E互为同分异构体的酯类化合物的结构简式(核磁共振氢谱为两组峰,峰面积比为1∶1)______________。
(7)苯乙酸苄酯( )是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线__________(无机试剂任选)。
)是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线__________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定的溶液中能大量共存的是( )
①常温下pH=1的溶液中:![]()
②![]() 溶液:
溶液:![]()
③中性透明溶液中:![]()
④加入Al能放出H2的溶液中:![]()
⑤能使红色石蕊试纸变为蓝色的溶液:![]()
⑥25℃时![]() 的溶液:
的溶液:![]()
A.②③B.①⑥C.③④⑤D.①⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤和石油等化石燃料对促进经济社会发展起到了重要的作用,这些燃料合理的综合利用是当前节能减排的要求。请回答下列问题:
(1)石油分馏是石油炼制的重要环节,这种操作是在_______(填设备名称)内完成的。工业上通常使用的分馏石油的方法有常压分馏和_____,分馏的目的是___________。
(2)石油不仅是重要的燃料,还是重要的化工原料的来源,如利用石油生产乙烯。为了使石油分馏产物进一步生成更多的乙烯、丙烯等短链烃而采取______措施。
(3)目前石油资源逐渐匮乏,人们把目光聚集到储量相对丰富的煤上。目前煤综合利用的主要方法是________________、________和煤的气化,煤气化涉及的化学方程式有:C+O2![]() CO2 2C+O2
CO2 2C+O2![]() 2CO _____________(写出第三个化学方程式)。
2CO _____________(写出第三个化学方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为 ,分析其结构,并回答下列问题:
,分析其结构,并回答下列问题:
(1)写出其分子式:____________________________________________。
(2)其中含有____个不饱和碳原子,分子中有____个双键。
(3)分子中的极性键有__________(写出2种即可)。
(4)分子中的饱和碳原子有______个,一定与苯环处于同一平面的碳原子有______个。
(5)分子中C—C===O键角约为__________,H—C≡C键角约为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com