
【题目】氨气是生产化肥、硝酸等的重要原料,合成塔中每生产lmolNH3,放出46.2kJ热量。
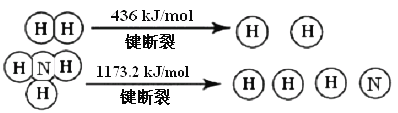
工业上合成氨的热化学方程式是___,断裂1molN![]() N键需要能量__kJ。
N键需要能量__kJ。
【答案】N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ/mol 946
2NH3(g) ΔH=-92.4 kJ/mol 946
【解析】
合成塔每生产lmolNH3,放出46.2kJ,发生合成氨的反应,生成2molNH3,放出的热量为92.4kJ,据此写出热化学方程式;反应热ΔH=反应物的总键能-生成物的总键能,断裂1molH2中的化学键吸收的热量为436 kJ,形成1molNH3中的化学键需要释放1173.2 kJ热量,根据反应热的公式进行计算。
合成搭每生产lmolNH3,放出46.2kJ,发生合成氨的反应,生成2molNH3,放出的热量为92.4kJ,热化学方程式为N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ/mol;
2NH3(g) ΔH=-92.4 kJ/mol;
反应热ΔH=反应物的总键能-生成物的总键能=E(N![]() N)+3×E(H-H)-2×3×E(N-H)= E(N
N)+3×E(H-H)-2×3×E(N-H)= E(N![]() N)+ 3×436-2×1173.2,计算得E(N
N)+ 3×436-2×1173.2,计算得E(N![]() N)=946 kJ。
N)=946 kJ。


科目:高中化学 来源: 题型:
【题目】化合物W可用作高分子膨胀剂,一种合成路线如下:

回答下列问题:
(1)A的化学名称为________。
(2)②的反应类型是__________。
(3)反应④所需试剂,条件分别为________。
(4)G的分子式为________。
(5)W中含氧官能团的名称是____________。
(6)写出与E互为同分异构体的酯类化合物的结构简式(核磁共振氢谱为两组峰,峰面积比为1∶1)______________。
(7)苯乙酸苄酯( )是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线__________(无机试剂任选)。
)是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线__________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表
化学方程式 | K(t1) | K(t2) |
F2+H2 | 1.8×1036 | 1.9×1032 |
Cl2+H2 | 9.7×1012 | 4.2×1011 |
Br2+H2 | 5.6×107 | 9.3×106 |
I2+H2 | 43 | 34 |
根据K的变化,结合已有知识推测,随着卤素原子核电荷数的降低,下列说法不正确的是
A.在相同条件下,平衡时X2的转化率逐渐升高
B.X2与H2反应的剧烈程度逐渐减弱
C.HX的还原性逐渐减弱
D.HX的生成为放热反应,由此可知t1<t2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁铵[aFe2(SO4)3·b(NH4)2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。
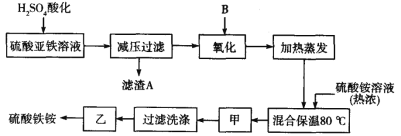
请回答下列问题:
(1)硫酸亚铁溶液加 H2SO4 酸化的主要目的是____________,滤渣 A的主要成分是______________。
(2)下列物质中最适合的氧化剂 B 是____________。
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
(3)操作甲、乙的名称分别是:甲_____________,乙_____________。
(4)上述流程中,有一处不严密,请指出并修改_____________。
(5)检验硫酸铁铵中NH4+的方法是_____________。
(6)称取 14.00 g 样品,将其溶于水配制成 100 mL 溶液,并分成两等份,向其中一份 中加入足量 NaOH 溶液,过滤洗涤得到 2.14 g 沉淀;向另一份溶液中加入 0.05 mol Ba(NO3)2 溶液,恰好完全反应。则该硫酸铁铵的化学式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为一定条件下采用多孔惰性电极的储氢电池充电装置(忽略其他有机物)。已知储氢装置的电流效率![]() ×100%,下列说法不正确的是
×100%,下列说法不正确的是
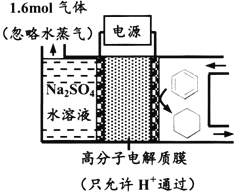
A. 采用多孔电极增大了接触面积,可降低电池能量损失
B. 过程中通过C-H键的断裂实现氢的储存
C. 生成目标产物的电极反应式为C6H6+6e-+6H+===C6H12
D. 若![]() =75%,则参加反应的苯为0.8mol
=75%,则参加反应的苯为0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.11g的D218O中含有的中子数为5NA
B.1 LpH=2的H2SO4溶液中H+的数目为0. 02NA
C.将0.1mol Cl2通入足量FeI2溶液中,转移电子的数目为0.2NA
D.标准状况下,4. 48 L甲烷与足量Cl2完全反应生成CH3Cl的分子数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】思维辨析:
(1) 互为同分异构体。_________
互为同分异构体。_________
(2)烯烃分子中所有原子都在同一平面上_________
(3)既可以用溴水鉴别甲烷和乙烯,又可以用溴水除去甲烷中的乙烯。_________
(4)煤中含有芳香烃,可以通过干馏的方法得到芳香烃。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素与人们的日常生活、生活和科学研究密不可分。请回答下列问题。
(1)乙烯具有水果催熟的功效,乙烯的电子式是______________。
(2)Al2O3真空碳热还原一氯化法是一种新的炼铝工艺,该法流程短,设备简单,符合目前国家提倡节能减排、改造升级的大环境。
①其中冶炼过程中发生的反应有:
(ⅰ)2Al2O3(s)+9C(s)=Al4C3(s)+6CO(g) △H1;
(ⅱ)Al2O3(s)+Al4C3(s)+3AlCl3(g)=9AlCl(g)+3CO(g) △H2;
(ⅲ)3AlCl(g)=AlCl3(g)+2Al(l) △H3;
则Al2O3(s)+3C(s)= 2Al(l)+ 3CO(g) △H4=___________________(用含△H1、△H2、△H3的代数式表示)。
②Al4C3是真空碳热还原一氯化法炼铝的中间产物,该物质与水反应生成最简单的有机物。该反应的化学方程式为__________________________________。
(3)利用活性炭的还原性可处理机动车的尾气(氮氧化物),发生如下反应C(s)+2NO(g)![]() N2(g)+CO2(g) △H>0,一定条件下,密闭容器中的有关物质的浓度与时间的变化如下表所示:
N2(g)+CO2(g) △H>0,一定条件下,密闭容器中的有关物质的浓度与时间的变化如下表所示:
时间/mim 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 | 0.6 |
N2 | 0 | 0.42 | a | b | 1.2 | 1.2 |
CO2 | 0 | 0.42 | a | b | 1.2 | 1.2 |
①0~20min内的平均反应速率v(CO2)=_______mol·L-1·min-1;第一次达到平衡的平衡常数K=__________。
②30min时只改变某一条件,则改变的条件可能是______________ (填字母编号)。
a.升高温度 b.降低温度 c.再通入一定量的NO
d.缩小容器的体积 e.加入合适的催化剂 f.增大容器休积
(4)炼钢炉中发生复杂的化学反应,其中包括反应:C(s)+CO2(g)![]() 2CO(g)△H>0。将1molCO2与足量的碳充入到一个恒压密闭容器中,总压强为P总。达到平衡时,容器内气体体积分数与温度的关系如下图:
2CO(g)△H>0。将1molCO2与足量的碳充入到一个恒压密闭容器中,总压强为P总。达到平衡时,容器内气体体积分数与温度的关系如下图:

①CO2体积分数为86%时,CO2的转化率为______________%(结果保留一位小数,下同)。
②已知:气体分压P分=P总×气体体积分数,达到平衡时用气体的分压代替气体浓度所表示的平衡常数为Kp,则900℃时,Kp=______________(用含p总的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com