
【题目】下图为一定条件下采用多孔惰性电极的储氢电池充电装置(忽略其他有机物)。已知储氢装置的电流效率![]() ×100%,下列说法不正确的是
×100%,下列说法不正确的是
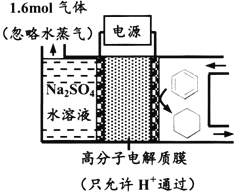
A. 采用多孔电极增大了接触面积,可降低电池能量损失
B. 过程中通过C-H键的断裂实现氢的储存
C. 生成目标产物的电极反应式为C6H6+6e-+6H+===C6H12
D. 若![]() =75%,则参加反应的苯为0.8mol
=75%,则参加反应的苯为0.8mol
【答案】B
【解析】
A. 多孔电极可增大电极与电解质溶液接触面积,降低能量损失,故A正确;
B. 该过程苯被还原为环己烷,C-H键没有断裂,形成新的C-H键,故B错误;
C. 储氢是将苯转化为环己烷,电极反应式为C6H6+6e-+6H+===C6H12,故C正确;
D. 根据图示,苯加氢发生还原反应生成环己烷,装置中右侧电极为阳极,根据放电顺序,左侧电极反应式为2H2O-4e-=O2↑+4H+,生成1.6molO2失去的电子量为6.4mol,根据阴阳得失电子守恒,阴极得到电子总数为6.4mol,若η=75%,则生成苯消耗的电子数为6.4mol×75%=4.8mol,苯发生的反应C6H6+6e-+6H+===C6H12,参加反应的苯的物质的量为4.8mol/6=0.8mol,故D正确;
故选B。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A. 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B. 0.1mol/LNa2CO3溶液与0.1mol/LNaHCO3溶液等体积混合:2c(Na+)=3c(CO32-)十3c(HCO3-)+3c(H2CO3)
C. 0.1mol/LNH4Cl溶液与0.1mol/L氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
D. 0.1mol/LNa2C2O4溶液与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是

A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃下,某反应达到平衡,平衡常数K=![]() 。恒容时,温度升高时NO浓度减小。下列 说法正确的是
。恒容时,温度升高时NO浓度减小。下列 说法正确的是
A.该反应的焓变为正值
B.若恒温下增大压强(缩小体积),则反应体系的颜色加深
C.在t℃时,加入催化剂,该反应的化学平衡常数增大
D.该反应化学方程式为NO+SO3![]() NO2+SO2
NO2+SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA 为阿伏加德罗常数的值。下列说法正确的是( )
A.18gD2O 和 18gH2O 中含有的质子数均为 10NA
B.12 g 石墨烯(单层石墨)中含有六元环的个数为 0.5 NA
C.标准状况下,5.6LCO2 与足量 Na2O2 反应转移的电子数为0.5 NA
D.某密闭容器盛有 1 mol N2 和 3 mol H2,在一定条件下充分反应,转移电子的数目为 6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是生产化肥、硝酸等的重要原料,合成塔中每生产lmolNH3,放出46.2kJ热量。
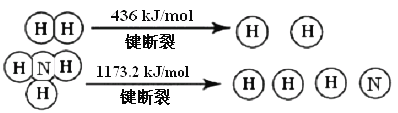
工业上合成氨的热化学方程式是___,断裂1molN![]() N键需要能量__kJ。
N键需要能量__kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳碳双键不能自由转动,所以R—CH==CH—R可有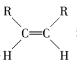 和
和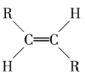 两种空间排列形式,判断下列化合物中具有上述两种空间排列形式的是
两种空间排列形式,判断下列化合物中具有上述两种空间排列形式的是
A.丙烯B.氯乙烯C.2-戊烯D.苯乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在CH3COONa溶液里,加入下列物质使水解平衡向左移动,并且pH变大的是 ( )
A. 加入适量纯CH3COOH
B. 加入少量NaCl固体
C. 加入少量NaOH固体
D. 加水稀释
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com