
【题目】以下化学用语及对应表达正确的是( )
A.H218O 的摩尔质量为20gmol﹣1
B.铁粉溶于盐酸的化学方程式:2Fe+6HCl=2FeCl3+3H2↑
C.氯离子的结构示意图: ![]()
D.乙醇的分子式为CH3CH2OH
 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源: 题型:
【题目】下列关于细胞中化学元素的叙述,正确的是
A. 细胞中一种元素的作用能被其他元素替代
B. 细胞中的脱氧核苷酸和脂肪酸都不含有氮元素
C. 主动运输机制有助于维持细胞内元素组成的相对稳定
D. 细胞中的微量元素因含量极少而不如大量元素重要
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有下列离子的溶液中滴加NaCl并通入足量SO2气体后,溶液中还可能大量共存的离子组是( )
A.NH4+、H+、NO3-B.H+、Fe2+、SO42-
C.Ag+、Fe3+、SO42-D.Fe3+、Ba2+、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或叙述正确的是
A. 1 mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642 kJ的热量:N2H4(l)+O2(g) ===N2(g)+2H2O(g) ΔH=+642 kJ·mol-1
B. 12 g石墨转化为CO时,放出110.5 kJ的热量:2C(石墨,s)+O2(g) ===2CO(g) ΔH=-110.5 kJ·mol-1
C. 已知:H2(g)+ ![]() O2(g) ===H2O(l) ΔH=-286 kJ·mol-1,则:2H2O(l) ===2H2(g)+O2(g)的ΔH=+572 kJ·mol-1
O2(g) ===H2O(l) ΔH=-286 kJ·mol-1,则:2H2O(l) ===2H2(g)+O2(g)的ΔH=+572 kJ·mol-1
D. 已知N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量
2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计“氯气与金属钠反应”的装置.实验操作:先给钠预热,到钠熔融成圆球时,停止加热,通入氯气,即可见钠着火燃
烧,并产生大量白烟.以下叙述错误的是( )
A.钠着火燃烧产生苍白色火焰和白烟
B.白烟是氯化钠微晶分散在空气中形成
C.玻管中部塞一团浸有NaOH溶液的棉球是为了吸收过量的氯气,以防污染环境
D.根据管右端棉球颜色的变化情况,可判断氯气是否被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO是一种性质活泼的大气污染物,它能与很多物质发生反应。
Ⅰ、在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2 (g)体系中,n(NO)随时间的变化如表:
2NO2 (g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=_____。已知:![]() >
>![]() ,则该反应是___热反应。
,则该反应是___热反应。
(2)下图中表示NO2的变化的曲线是___________。用O2表示从0-2 s内该反应的平均速率
v =___________。

(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
Ⅱ、超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO![]() 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO)(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)上述条件下反应能够自发进行,则该反应的△H_____0(填写“>”、“<”、“=”)。
(2)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(3)某同学设计了三组实验,实验条件已经填在下面实验设计表中,分析表格我们可以看出该同学的实验目的主要是研究_______________和_____________________对化学反应速率的影响。
实验编号 | T(℃) | NO初始浓(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧光盘金属层中的少量Ag,某科研小组采用如下方案进行回收(金属层中其他金属含量过低,对实验的影响可忽略)。
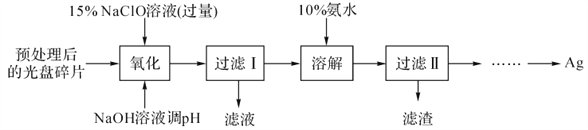
已知:①NaClO溶液在受热或酸性条件下易分解,如:3NaClO =2NaCl+NaClO3
②AgCl可溶于氨水:AgCl+2NH3·H2O =Ag(NH3)2++Cl-+2H2O
③常温时N2H4·H2O(水合肼)能还原Ag(NH3)2+:
4 Ag(NH3)2++N2H4·H2O=4Ag↓+N2↑+4NH4++4NH3↑+H2O
(1)“氧化”阶段需在80℃条件下进行,适宜的加热方式为___________。
(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为___________。HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是________________。
(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并________________。
(4)从“过滤Ⅱ”后的滤液中获取单质Ag的过程中,在加入2 mol/L水合肼溶液后,后续还需选用的试剂有________________(①1 mol/LH2SO4、②10%氨水、③1 mol/LNaOH溶液,填序号)。反应完全后获取纯净的单质银再进行的实验操作过程简述为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com