
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol
890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是
A.C(s)+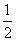 O2(g)=CO(g) △H= ―393.5 kJ/mol
O2(g)=CO(g) △H= ―393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(l) △H= +571.6 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= ―890.3 kJ/mol
D.C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H=―2800 kJ/mol
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
下列说法正确的是
A.纤维素属于多糖,在人体内水解转化为葡萄糖,也可为人类提供能量
B.糖尿病患者吃糖量必须限制,但淀粉类食物不必进行限制
C.同质量的脂肪在体内氧化放出的能量比糖类和蛋白质高得多,是提供能量的主要物质
D.葡萄糖在人体内不可以转化为脂肪,所以吃糖不会使人发胖
查看答案和解析>>
科目:高中化学 来源: 题型:
分类法是一种行之有效、简单易行的科学方法。某同学用如表所示的形式对所学知识进行分类,甲与乙、丙、丁是包含关系。其中正确的是
| 选项 | 甲 | 乙、丙、丁 |
| A | 弱电解质 | 一水合氨、水、硫酸钡 |
| B | 腐蚀品 | 浓硫酸、烧碱、硝酸 |
| C | 碱性氧化物 | 过氧化钠、氧化镁、氧化铁 |
| D | 合成高分子材料 | 光导纤维、涤纶、玻璃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
A.1:4 B.1:5 C..2:3 D.2:5
查看答案和解析>>
科目:高中化学 来源: 题型:
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
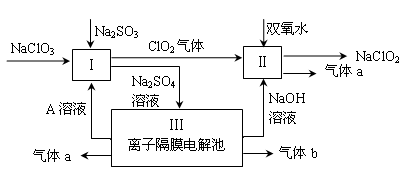 |
(1)Ⅰ中发生反应的还原剂是 (填化学式)。
(2)Ⅱ中反应的离子方程式是 。
(3)A的化学式是 ,气体b的化学式是 ,
装置Ⅲ中发生反应的化学方程式是 。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:
5NaClO2 + 4HCl = 5NaCl + 4ClO2↑ + 2H2O。
① 该反应中氧化剂和还原剂的物质的量之比是 。
② 研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A.在化学反应过程中,发生物质变化的同时不一定发生能量变化
B.生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,
反应为吸热反应
C.反应产物的总焓大于反应物的总焓时,反应吸热,ΔH>0
D.ΔH的大小与热化学方程式的计量系数无关
查看答案和解析>>
科目:高中化学 来源: 题型:
强已知反应:① 2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
101KPa ② 稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol
下列结论正确的是
A.碳的燃烧热等于110.5 kJ/mol
B.①的反应热为221 kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量
查看答案和解析>>
科目:高中化学 来源: 题型:
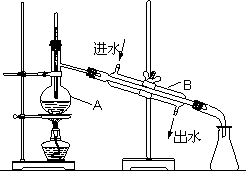
右图为实验室制取自来水的装置示意图,根据图示回答下列问题。
(1)图中有 (填数值)处明显的错误。
(2)A仪器的名称是 ,B仪器的名称是 。
(3)实验时A中除加入适量自来水外,还需加入少量 ,其作用是 。
(4)要检测锥形瓶中的蒸馏水是否含有Cl-,需要的两种化学试剂是(填化学式) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com