
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:
某溶液中可能含有H+、Na+、NH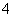 、Mg2+、Fe3+、Al3+、SO
、Mg2+、Fe3+、Al3+、SO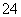 、CO
、CO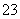 等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是( )
等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是( )
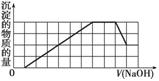
A.原溶液中含有的阳离子是H+、NH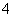 、Mg2+、Al3+
、Mg2+、Al3+
B.原溶液中含有的Fe3+和Al3+的物质的量之比为1∶1
C.原溶液中一定含有SO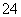 和Na+
和Na+
D.反应最后形成的溶液中溶质只有Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol
890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是
A.C(s)+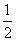 O2(g)=CO(g) △H= ―393.5 kJ/mol
O2(g)=CO(g) △H= ―393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(l) △H= +571.6 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= ―890.3 kJ/mol
D.C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H=―2800 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生活、社会密切相关。下列说法正确的是
A.光纤通信使用的光缆的主要成分是晶体Si,太阳能电池使用的材料主要是SiO2
B.氨很容易液化,液氨气化吸收大量的热,所以液氨常用作制冷剂
C.高锰酸钾溶液、酒精、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性
D.SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.20 mol NO和0.1 mol CO充入一个容积恒定为1L的密闭容器中发生反应:
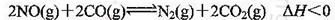
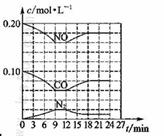 在不同条件下,反应过程中部分物质的浓度变化如图所示。
在不同条件下,反应过程中部分物质的浓度变化如图所示。
下列说法正确的是
A.容器内的压强不发生变化说明该反应达到平衡
B.当向容器中再充入0.20 mol NO时,平衡向正反应方
向移动,K增大
C.第12 min时改变的反应条件为升高温度
D.向该容器内充入He气,容器内气体压强增大,所以
反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
某中学化学兴趣小组为了调查当地某一湖泊的水质污染情况,在注入湖泊的3 个主要水源的入口处采集水样,并进行了分析,给出了如下实验信息:其中一处水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E为五种常见化合物,均由下表中的离子形成:
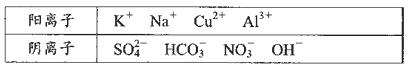
为了鉴别上述化台物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
@进行焰色反应,只有B、c为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸锁溶液,再加过量稀硝酸,A中放出无色气体,C、D中都能产
生白色沉淀:
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、D的化擎式:B________,D________。
(2)将含I mol A的溶液与含l molE的溶液反应后蒸于,仅得到一种化台物,该化合物的化学式为_____________.
(3)在A溶液中加入少量澄清石灰水,其离子方程式为________________。
(4)C常用作净水剂,用离子方程式和适当文字说明其净水原理_____________。
(5)若向含溶质lmol的C溶液中逐滴加入Ba(OH)2溶液,生成沉淀质量最大为______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.容量瓶、烧杯、量筒使用前均需要验漏、洗净并烘干
B.分液时,需先打开分液漏斗上端的玻璃塞,再将下层液体从下口放出
C.将硫酸铜溶液蒸发至有大量固体析出时,停止加热,便可得到胆矾晶体
D.配制一定物质的量浓度溶液时,当容量瓶中液面高于刻度线时,用胶头滴管吸出少量液体即可
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需要0.1 mol/L NaOH溶液450 mL和0.5 mol/L硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
①如图所示的仪器中,配制溶液肯定不需要的是__________________________ (填序号),配制上述溶液还需用到的玻璃仪器有 (填仪器名称)。
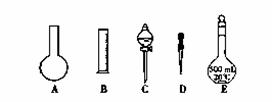
②配制0.1 mol/L NaOH溶液时,其正确的操作顺序是(字母表示,每个字母只能用一次) 。
A.将容量瓶盖紧,振荡,摇匀
B.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
C.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
D.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
E.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
F.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
③配制0.1 mol/L NaOH溶液时,在实验中其他操作均正确,若定容时仰视容量瓶刻度线,则所配溶液浓度 0.1 mol/L(填“大于”、“等于”或“小于”)。
④配制0. 5 mol/L硫酸溶液500 mL时,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为 mL(计算结果保留一位小数)。
⑤配制0.5 mol/L硫酸溶液时,在实验中其他操作均正确,若用量筒量取浓硫酸时仰视刻度线,则所配溶液浓度 0.5 mol/L(填“大于”、“等于”或“小于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com