
【题目】下列能大量共存的离子组是
A.NH4+、Mg2+、OH-、Cl- B.Ba2+、K+、SO42-、NO3-
C.Al3+、Cu2+、SO42-、Cl- D.Na+、Al3+、Cl-、AlO2-
科目:高中化学 来源: 题型:
【题目】含1 mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物与铁粉物质的量的关系如图所示(已知稀硝酸的还原产物只有NO),回答下列问题:
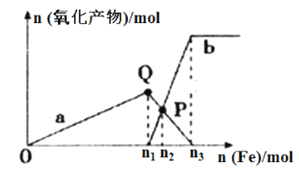
(1)曲线a表示_______________;曲线b表示_____________(填写Fe2+或Fe3+)。
(2)P点时总反应的离子方程式可表示为_______________________。
(3)n3︰n2=________________(请写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验:①![]()
![]() 溶液和
溶液和![]() 溶液各1mL混合得到红色溶液a,均分溶液a置于b、c两支试管中;
溶液各1mL混合得到红色溶液a,均分溶液a置于b、c两支试管中;
②向b中滴加3滴饱和![]() 溶液,溶液颜色加深;
溶液,溶液颜色加深;
③再向上述b溶液中滴加3滴![]() 溶液,溶液颜色变浅且出现浑浊;
溶液,溶液颜色变浅且出现浑浊;
④向c中逐渐滴加![]() 溶液
溶液![]() ,溶液颜色先变深后变浅。
,溶液颜色先变深后变浅。
下列分析不正确的是
A. 实验②中增大![]() 浓度使平衡
浓度使平衡![]() 正向移动
正向移动
B. 实验③中发生反应: ![]()
C. 实验③和④中溶液颜色变浅的原因相同
D. 实验②、③、④均可说明浓度改变对平衡移动的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下能量关系示意图,下列说法正确的是

A. 1 mol C(g)与1 mol O2(g)的能量之和为393.5 kJ
B. 反应2CO(g)+O2(g) ==2CO2(g)中,生成物的总能量大于反应物的总能量
C. 由C→CO的热化学方程式为:2C(s)+O2(g) ==2CO(g) ΔH= 221.2 kJmol1
D. 热值指一定条件下单位质量的物质完全燃烧所放出热量,则CO热值ΔH= 10.1 kJmol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)中,4 mol HCl被氧化,放出115.6 kJ的热量。又知:
2Cl2(g)+2H2O(g)中,4 mol HCl被氧化,放出115.6 kJ的热量。又知:![]() ,判断下列说法正确的是( )
,判断下列说法正确的是( )
A. 该反应的ΔH=+115.6 kJ·mol-1
B. 断开1 mol H—O 键与断开1 mol H—Cl 键所需能量相差约为32 kJ
C. H2O中H—O 键比HCl中H—Cl键弱
D. 由所提供数据判断氯元素的非金属性比氧元素强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 A、B、C、D、E 是化学中常见的物质。常温下,E 是一种无色无味的液体,它们之间有如下反应关系。
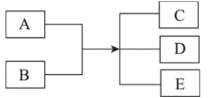
(1)若 A 是一种具有磁性的黑色金属氧化物,B 是一种常见的非氧化性酸,A 和 B 反应的离子方程式为________;若在生成物 C 中继续滴加氢氧化钠溶液,会观察到生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色,写出白色沉淀发生化学反应的方程式________________________________。A 与 CO 高温下反应可得到金属单质,写出该金属单质与水蒸气反应的化学方程式________________________________。
(2)若实验室中利用固体 A 和 B 的反应制备气体 C,C 是一种无色、刺激性气味、密度比空气小、碱性的气体,试写出此反应的化学方程式________________________________;实验室检验 C 的方法为________________________________。
(3)若 B 是黄绿色有毒气体,上述关系经常用于实验室尾气处理,则反应的离子方程式为
________________________________。若用湿润的淀粉碘化钾试纸靠近盛满 B 的试管口,看到的现象为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
③C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活,甲烷细菌使1mol甲烷生成CO2气体与液态水,放出的能量________(填“>”“<”或“=”)890.3kJ。
(2)甲烷与CO2可用于合成水煤气(主要成分是一氧化碳和氢气):CH4+CO2=2CO+2H2,1gCH4完全反应可释放15.46kJ的热量,则:
①能表示该反应过程中能量变化的是________(填字母)。



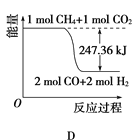
②若将物质的量均为1mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化如图所示,则CH4的转化率为________。
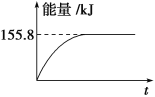
(3)C(s)与H2 (g)不反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)=CH4(g)的反应热ΔH=_____。
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是_______(填字母)。
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成水煤气(CO、H2)
D.将固态碳合成为C60,以C60作为燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硫酸铜饱和溶液中放入硫酸铜晶体后,该系统存在的过程是
A. 只存在溶解过程 B. 只存在结晶过程
C. 同时存在溶解和结晶过程 D. 不存在溶解和结晶过程
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com