
【题目】在浓度均为6 mol·L-1的盐酸和硫酸各100 mL溶液中,分别加入等质量的铁粉,充分反应后生成气体体积比为2∶3,则加入铁粉的质量是 ( )
A.11.2 g B.25.2 g C.16.8 g D.33.6 g
【答案】B
【解析】
试题分析:发生反应为:Fe+2HCl![]() FeCl2+H2↑①、Fe+H2SO4
FeCl2+H2↑①、Fe+H2SO4![]() FeSO4+H2↑②,加入铁粉质量相等,如果对于这两个反应都是铁不足,则Fe完全反应,生成气体体积之比为1:1,若酸都不足,则酸完全反应,根据方程式可知,生成的气体体积之比为1:2,而实际气体体积之比为2:3,所以肯定是铁对一个反应来说是不足,对于另一个反应是过量。通过方程式可以看出来,铁消耗HCl多,对于①反应来说是盐酸不足,对于②反应是Fe不足,铁与盐酸反应生成气体的物质的量为
FeSO4+H2↑②,加入铁粉质量相等,如果对于这两个反应都是铁不足,则Fe完全反应,生成气体体积之比为1:1,若酸都不足,则酸完全反应,根据方程式可知,生成的气体体积之比为1:2,而实际气体体积之比为2:3,所以肯定是铁对一个反应来说是不足,对于另一个反应是过量。通过方程式可以看出来,铁消耗HCl多,对于①反应来说是盐酸不足,对于②反应是Fe不足,铁与盐酸反应生成气体的物质的量为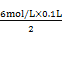 =0.3mol,反应完毕后生成气体的体积之比为2:3,所以由硫酸生成的气体的物质的量为0.45mol,设铁的质量为x,则:
=0.3mol,反应完毕后生成气体的体积之比为2:3,所以由硫酸生成的气体的物质的量为0.45mol,设铁的质量为x,则:
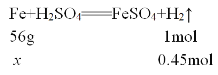
解得x=25.2g,故该题选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】依据下列甲、乙、丙三图,判断下列叙述不正确的是( )
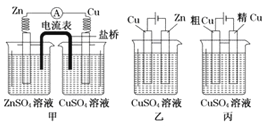
A.甲是原电池,乙是电镀装置 B.甲、乙装置中,锌极上均发生氧化反应
C.乙、丙装置中,阳极均发生氧化反应而溶解 D.丙装置中,铜电极的质量有增有减
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠样品中含有少量的杂质Na2SO4,按下列流程进行净化,请在流程中的( )中写上合适的试剂,在[ ]中写上实验操作名称。写出有关反应的化学方程式:
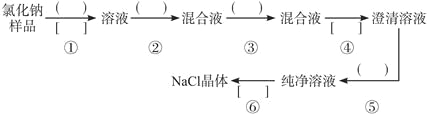
(1)操作①、②、③、⑤中所需加入试剂分别为________、_________、_________、________。
(2)操作①、④、⑥的操作名称分别为_________、_________、_________。
(3)写出有关的化学方程式:
第②步:_____________________________。
第⑤步:_____________________________。
(4)操作④所用到的玻璃仪器有_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知吸热反应2CO(g) = 2C(s)+O2(g) ,设ΔH 和ΔS不随温度而变,下列说法中正确的是
A. 低温下能自发进行 B. 高温下能自发进行
C. 任何温度下都能自发进行 D. 任何温度下都不能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表
2NO2(g)体系中,n(NO)随时间的变化如表
![]()
(1)下图中表示NO2的变化的曲线是___________。用O2表示从0~2s内该反应的平均速率v=________________________。
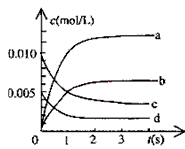
(2)能说明该反应已达到平衡状态的是___________ 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是_____________ 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定体积的HCl气体,将其溶于100mL稀硫酸中,假设溶液的体积不变,向混合溶液中加入4molL-1的NaOH溶液10mL恰好呈中性.继续向所得中性溶液中滴入过量的Ba(OH)2 溶液,所得沉淀质量为2.33g.
(1)生成沉淀的化学方程式为_________________________.
(2)硫酸的物质的量浓度:![]() =____________________________.
=____________________________.
(3)该HCl气体在标准状况下的体积为_____________mL.
(4)若向该混酸溶液(仍为100mL)中加入Na2CO310H2O晶体,直到不再产生气体时为止,消耗Na2CO310H2O晶体的质量为____________g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中的信息,回答下列问题 :
溶质的物质的量浓度/ | 溶液的密度/ |
| |
硫酸 |
|
| |
氨水 |
|
|
(1)表中硫酸的质量分数为__________(不写单位,用含![]() 、
、![]() 的代数式表示)。
的代数式表示)。
(2)物质的量浓度为![]()
![]() 的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为___________
的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为___________![]() 。
。
(3)物质的量浓度为![]()
![]() 的氨水与
的氨水与![]()
![]()
![]() 的氨水等质量混合,所得溶液的密度______(填
的氨水等质量混合,所得溶液的密度______(填
“大于”、“小于”或“等于”,下同) ![]()
![]() ,所得溶液的物质的量浓度________
,所得溶液的物质的量浓度________![]()
![]()
![]()
(设混合后溶液的体积变化忽略不计)
(4)若将稀硫酸与氨水混合,写出其反应的离子方程式___________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙为常见单质。A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色。在一定条件下,各物质相互转化关系如图所示。
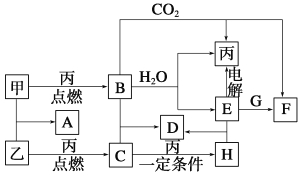
请回答下列问题:
(1)用化学式表示:丙为__________,H为__________。
(2)A的电子式为________________________________。
(3)电解E的水溶液时,E起到的作用是_______________________
(4)写出B+C―→D的化学方程式______________________________
写出E+G―→F的离子方程式___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒电池以惰性材料作电极,在电解质溶液中发生的电池总反应为:VO2+(蓝色)+H2O+V3+(紫色)![]() VO2+(黄色)+V2+(绿色)+2H+ 下列说法错误的( )
VO2+(黄色)+V2+(绿色)+2H+ 下列说法错误的( )
A. 充电时,反应每生成2molH+时电子转移的物质的量为2mol
B. 放电过程中,正极附近溶液的酸性减弱
C. 放电时,正极反应为VO2++2H++e-=VO2++H2O
D. 充电时,阳极附近溶液由蓝色逐渐变为黄色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com