
【题目】一学生用如图装置研究原电池原理,下列说法错误的是( )
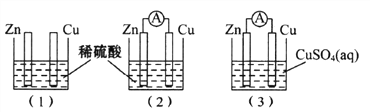
A. (1)图中铜棒上没有气体产生
B. (2)图中如果两极上都有气体产生,则说明锌片不纯
C. (2)图与(3)图中正极生成物质质量比为1:32时,锌片减轻的质量相等
D. (3)图中锌片增重质量与铜棒减轻质量的比值为65:64
【答案】D
【解析】A、装置图1是化学腐蚀,锌和稀硫酸发生反应生成氢气,铜和稀硫酸不反应,图1中铜棒上没有气体产生,故A正确;B、图2是原电池装置,锌做负极,铜做正极溶液中氢离子在铜电极生成氢气,锌片不纯会形成原电池,锌片表面也有气体生成,故B正确;C、(2)图与(3)图中电极反应负极Zn-2e-=Zn2+,图2中正极上电极反应2H++2e-=H2↑,图3中正极电极反应为Cu2++2e-=Cu,正极生成物质质量比为1:32时,依据电子守恒计算两个原电池中电子转移相同,所以反应的锌的质量相同,故C正确;D、图3是原电池装置,锌做负极失电子生成锌离子,铜做正极,溶液中铜离子得到电子生成铜,锌电极减轻,铜电极增重,故D错误;故选D。


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.加入过量氨水,有白色沉淀生成,则原溶液一定有Al3+
B.加入K3[Fe(CN)6]溶液,产生特征蓝色沉淀,则原溶液一定有Fe3+
C.加入盐酸酸化的BaCl2溶液,有白色沉淀生成,则原溶液一定有SO42-
D.加入NaOH溶液,产生气体使湿润的红色石蕊试纸变蓝,则原溶液一定有NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图中所示的装置进行实验,实验现象与预测不一致的是( )
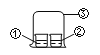
选项 | ①中的物质 | ②中的物质 | 预测现象 |
A | 浓氨水 | FeCl3溶液 | ②中有红褐色沉淀 |
B | 浓氨水 | 浓盐酸 | ③中有白烟 |
C | 浓硝酸 | 淀粉KI溶液 | ②中溶液无明显变化 |
D | 浓盐酸 | 酚酞溶液 | ②中溶液无明显变化 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生的实验报告所列出的下列数据中合理的是( )
A.用10mL量筒量取7.13mL稀盐酸
B.用托盘天平称量25.20g NaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有短周期元素 A、B、C, 其中 A、B 同周期,B、C 同主族,三元素原子的最外层电子数之和为 17, 核电荷数之和为 31,则 A、B、C 为( )
A. C、N、P B. N、O、S C. N、P、 O D. C、O、S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
①移去生成物②升高温度③增大压强④增大反应物的浓度⑤加入催化剂.
A.①②③④⑤
B.②③④⑤
C.②⑤
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将N2、H2的混合气体分别充入甲、乙、丙三个容器中,进行合成氨反应,经过相同的一段时间后,测得反应速率分别为:甲:v(H2)=3 mol·L-1·min-1;乙:v(N2)=2 mol·L-1·min-1;丙:v(NH3)= 1 mol·L-1·min-1。则三个容器中合成氨的反应速率
A. v(甲)>v(乙)>v(丙) B. v(乙)>v(丙)>v(甲)
C. v(丙)>v(甲)>v(乙) D. v(乙)>v(甲)>v(丙)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,水的电离平衡:H2O![]() H++OH-ΔH>0,下列叙述正确的是
H++OH-ΔH>0,下列叙述正确的是
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C. 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D. 将水加热,Kw增大,c(H+)不变,pH不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com