
| A、pH=12 的Ba(OH)2 |
| B、pH=12的氨水 |
| C、0.01mol/L NaOH |
| D、0.05mol/L BaCl2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
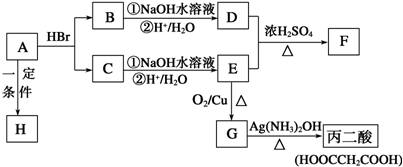
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤经气化和液化两个物理过程后可变为清洁能源,这是煤综合利用的主要方法 |
| B、蛋白质、淀粉、纤维素、油脂等都能在人体内水解并提供能量 |
| C、利用风能发电、使用太阳能热水器、应用无氟制冷剂均有利于降低大气中的二氧化碳 |
| D、钢筋混凝土、玻璃钢、石棉瓦、碳纤维增强陶瓷都是常见的复合材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
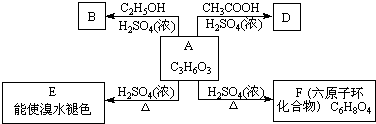
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量牙膏样品,加水成分搅拌、过滤,得滤液A和沉淀B. | |
| 步骤2: | |
| 步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:
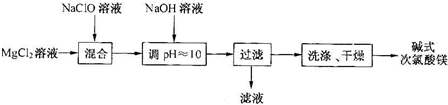
| m(Cl2) |
| m(次氯酸盐) |
查看答案和解析>>
科目:高中化学 来源: 题型:
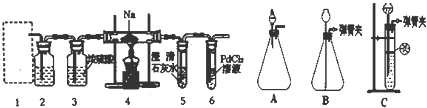
查看答案和解析>>
科目:高中化学 来源: 题型:
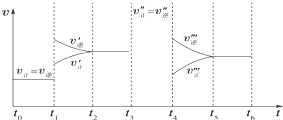 密闭容器中发生如下反应:A(g)+3B(g)?2C(g);△H<0,根据下列速率-时间图象,下列说法不正确的是( )
密闭容器中发生如下反应:A(g)+3B(g)?2C(g);△H<0,根据下列速率-时间图象,下列说法不正确的是( )| A、下列时刻所改变的外界条件是:t1升温;t3加催化剂;t4减压 |
| B、产物C的体积分数最大的时间段是t0~t1段 |
| C、上述图象中C的体积分数相等的时间段是t2~t3段与t3~t4段 |
| D、反应速率最大的时间段是t0~t1段 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com