
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量牙膏样品,加水成分搅拌、过滤,得滤液A和沉淀B. | |
| 步骤2: | |
| 步骤3: |
| 实验步骤 | 预期现象和结论 |
| 步骤2:取适量沉淀B于试管中,滴加过量稀盐酸 | 出现无色气泡,说明含有碳酸钙 |
| 步骤3:取步骤2的上层清液,滴加氢氧化钠溶液 | 先生成沉淀,后沉淀溶解,说明含有氢氧化铝 |
| 3.75g |
| 20.0g |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
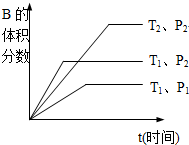
查看答案和解析>>
科目:高中化学 来源: 题型:
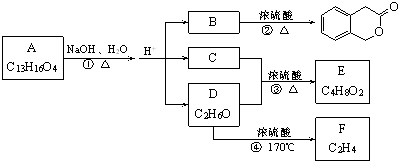
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=12 的Ba(OH)2 |
| B、pH=12的氨水 |
| C、0.01mol/L NaOH |
| D、0.05mol/L BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
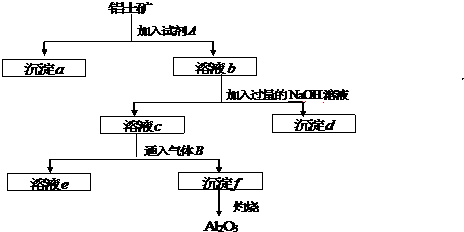
查看答案和解析>>
科目:高中化学 来源: 题型:
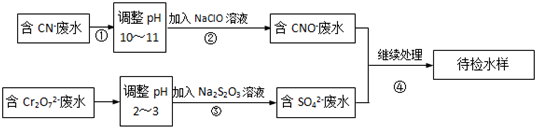
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | CH3CH3 | CH2=CH2 | H2 | 加热 |
| B | CH3COOCH2CH3 | CH3COOH | Na2CO3 | 蒸馏 |
| C | CH3CH2OH | H2O | CaO | 蒸馏 |
| D | CH3COOH | CH3CH2OH | Na2CO3 | 分液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增加压强 |
| B、降低温度 |
| C、增大H2O(g) 的浓度 |
| D、更换催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com