
| A、增加压强 |
| B、降低温度 |
| C、增大H2O(g) 的浓度 |
| D、更换催化剂 |


科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量牙膏样品,加水成分搅拌、过滤,得滤液A和沉淀B. | |
| 步骤2: | |
| 步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
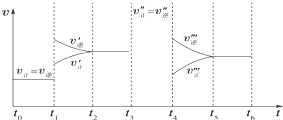 密闭容器中发生如下反应:A(g)+3B(g)?2C(g);△H<0,根据下列速率-时间图象,下列说法不正确的是( )
密闭容器中发生如下反应:A(g)+3B(g)?2C(g);△H<0,根据下列速率-时间图象,下列说法不正确的是( )| A、下列时刻所改变的外界条件是:t1升温;t3加催化剂;t4减压 |
| B、产物C的体积分数最大的时间段是t0~t1段 |
| C、上述图象中C的体积分数相等的时间段是t2~t3段与t3~t4段 |
| D、反应速率最大的时间段是t0~t1段 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在其他条件不变时,对于反应2SO2(g)+O2(g)?2SO3(g)起始SO2与 O2按1:1的投料比加入,反应达到平衡后,若继续通入SO2,反应重新达平衡后,则SO3体积分数增大 |
| B、因常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)很容易进行,故该反应的△H<0 |
| C、在其他条件不变时,向H2(g)+I2(g)?2HI(g)平衡体系中加催化剂,反应速率加快,I2转化率不变 |
| D、14CO2与碳在高温条件下发生反应:CO2+C?2CO达到化学平衡后,平衡混合物中含14C的微粒有CO2、C、CO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②④ | C、①④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
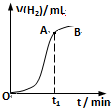 某学生用质量为a g,边长为b cm的正方形镀锌铁片与过量盐酸反应测定锌镀层的厚度,并将实验结果绘成曲线图.反应完毕铁片的质量为c g(已知锌的密度为ρ g/cm3).下列叙述错误的是( )
某学生用质量为a g,边长为b cm的正方形镀锌铁片与过量盐酸反应测定锌镀层的厚度,并将实验结果绘成曲线图.反应完毕铁片的质量为c g(已知锌的密度为ρ g/cm3).下列叙述错误的是( )| A、t1时刻锌镀层已完全反应 | ||
B、锌镀层的厚度为
| ||
| C、反应放热也是影响OA段反应速率的因素之一 | ||
| D、烘干时间过长,会导致测定结果偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com