
| A、①② | B、②④ | C、①④ | D、③④ |


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
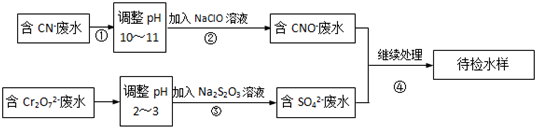
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增加压强 |
| B、降低温度 |
| C、增大H2O(g) 的浓度 |
| D、更换催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| c2(NO2) |
| c2(NO)c(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业上通过电解熔融的氯化钠来制取金属钠 |
| B、钠投入到硫酸铜溶液中有大量的铜析出 |
| C、钠钾合金可在中子反应堆中作热交换剂 |
| D、钠可用于从钛、铌等金属的氯化物中置换出金属单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com