
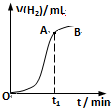
 某学生用质量为a g,边长为b cm的正方形镀锌铁片与过量盐酸反应测定锌镀层的厚度,并将实验结果绘成曲线图.反应完毕铁片的质量为c g(已知锌的密度为ρ g/cm3).下列叙述错误的是( )
某学生用质量为a g,边长为b cm的正方形镀锌铁片与过量盐酸反应测定锌镀层的厚度,并将实验结果绘成曲线图.反应完毕铁片的质量为c g(已知锌的密度为ρ g/cm3).下列叙述错误的是( )| A、t1时刻锌镀层已完全反应 | ||
B、锌镀层的厚度为
| ||
| C、反应放热也是影响OA段反应速率的因素之一 | ||
| D、烘干时间过长,会导致测定结果偏小 |
| ||
| 2b2 |
| (a-c)g |
| ρg/cm3 |
| a-c |
| ρ |
| ||
| 2b2cm2 |
| a-c |
| 2ρb2 |


科目:高中化学 来源: 题型:
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | CH3CH3 | CH2=CH2 | H2 | 加热 |
| B | CH3COOCH2CH3 | CH3COOH | Na2CO3 | 蒸馏 |
| C | CH3CH2OH | H2O | CaO | 蒸馏 |
| D | CH3COOH | CH3CH2OH | Na2CO3 | 分液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增加压强 |
| B、降低温度 |
| C、增大H2O(g) 的浓度 |
| D、更换催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c2(NO2) |
| c2(NO)c(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3Cl2+6KOH═5KCl+KClO3+3H2O | ||||
| B、2NO2+2NaOH═NaNO3+NaNO2+H2O | ||||
C、MnO2+4HCl(浓)
| ||||
| D、3CCl4+K2Cr2O7═2CrO2Cl2+3COCl2↑+2KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | E | F | G | H | I | J | |
| 原子半径 (10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com