
 A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻.G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体.以上物质相互间的转化关系如图所示:请回答下列问题:
A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻.G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体.以上物质相互间的转化关系如图所示:请回答下列问题: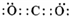 ,故答案为:
,故答案为: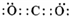 ;
;
| ||
| ||
| ||
| ||
| ||
| ||
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:

| A、这是一个原电池装置 |
| B、该装置中Pt为正极,电极反应为:O2+2H2O+4e-═4OH- |
| C、该装置中Fe为阴极,电极反应为:Fe-2e-+2OH-═Fe(OH)2 |
| D、溶液中会出现红褐色的沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:
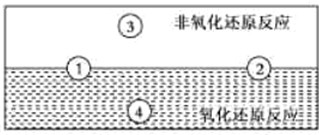
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | |||||||||||||||||
| B | C | ||||||||||||||||
| D | E | ||||||||||||||||

| 元素 | D | E | |
| 电离能 /kJ?mol-1 |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、装置中出口①处的物质是氯气,出口②处的物质是氢气 | ||||
B、装置中发生反应的离子方程式为:2Cl-+2H+
| ||||
| C、该装置是将电能转化为化学能 | ||||
| D、该离子交换膜只能让阳离子通过,不能让阴离子通过 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 g/L |
| B、1.5 g/L |
| C、2 g/L |
| D、3 g/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com