
【题目】下列各种关于酸的使用,其中正确的是
A. 为了抑制Fe2+的水解,用稀硝酸酸化 B. 检验溶液中是否含有SO42—时,先用盐酸酸化
C. 检验氯乙烷中的氯元素,水解后再用硫酸酸化 D. 为了增强KMnO4溶液的氧化能力,用浓盐酸酸化
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某学习小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
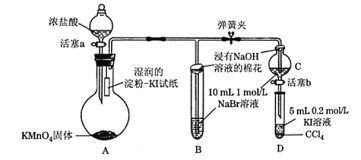
实验过程:
Ⅰ. 打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ. 当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ. 当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
回答问题:
(1)A中产生黄绿色气体,其电子式是_____。实验室在加热条件下制取该气体的离子方程式为_______。
(2)验证氯气的氧化性强于碘单质的实验现象是____________。
(3)C中溶液发生反应的离子方程式是_______________。
(4)过程Ⅲ实验的目的:甲同学认为试管B的作用就是吸收尾气,防止多余Cl2污染空气,因此B中盛装的最佳试剂应该为________。
乙同学经分析认为,B中溶液由黄色变为棕红色,发生反应的化学方程式为____________,以此说明C中_________,从而得出D中氧化I-的氧化剂必为Br2,因此B装置是必不可少的。
(5)过程Ⅳ为:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下试管D震荡,静置,观察到的现象为___________,发生反应的离子方程式为_________。
(6)氯、溴、碘单质的氧化性逐渐减弱的本质原因:同主族元素从上到下_________,得电子能力逐渐减弱。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A. 20gD2O与20g氖气所含有的电子数相同
B. 标准状况下,22.4L二氯甲烷的分子数约为NA
C. 常温常压下,100g 17%的双氧水溶液中含有氧原子总数为NA
D. 56g铁与一定量的氯气在一定条件下充分反应,转移的电子数一定为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个容积相同的容器中,一个盛有HCl气体,另—个盛有H2和Cl2的混合气体。在同温同压下, 两容器内的气体一定具有相同的( )
A. 原子数 B. 密度 C. 质量 D. 质子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验制备2-羟基-4-苯基丁酸乙酯,反应原理、装置和数据如下:


相对分子质量 | 密度(g/cm3) | 沸点(℃) | 水溶性 | |
2-羟基-4-苯基丁酸 | 180 | 1.219 | 357 | 微溶 |
乙醇 | 46 | 0.789 | 78.4 | 易溶 |
2-羟基-4-苯基丁酸乙酯 | 208 | 1.075 | 212 | 难溶 |
实验步骤:
①如图1,在干燥的圆底烧瓶中加入20mL2-羟基-4-苯基丁酸、20mL无水乙醇和适量浓硫酸,再加入几粒沸石;
②加热至70℃左右保持恒温半小时;
③分离、提纯三颈瓶中的粗产品,得到有机粗产品;
④精制产品。
请回答下列问题:
(1)油水分离器的作用为____________________。实验过程中发现忘记加沸石该如何操作_______________________。
(2)本实验采用____________加热方式(填“水浴”、“油浴”或“酒精灯加热”)。
(3)取三颈烧瓶中的混合物分别用水、饱和碳酸氢钠溶液和水洗涤。第二次水洗的目的是___________________。
(4)在精制产品时,加入无水MgSO4的作用为___________________;然后过滤,再利用如图2装置进行蒸馏纯化,图2装置中的错误有__________________________。
(5)若按纠正后的操作进行蒸馏纯化,并收集212℃的馏分,得2-羟基-4-苯基丁酸乙酯约9.0g。则该实验的产率为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验事实的方程式正确的是
A. 碳酸钠溶液呈碱性:CO32— + 2H2O ![]() H2CO3 + 2OH-
H2CO3 + 2OH-
B. 氢氧化亚铁在空气中变质:2Fe(OH)2+O2+2H2O = 2Fe(OH)3
C. 铜片溶于稀硝酸产生无色气体:Cu+4H++2NO3—=Cu2++2NO2↑+2H2O
D. 用氢氧化钠溶液去除铝条表面的氧化膜:Al2O3+2OH-=2AlO2-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答问题:
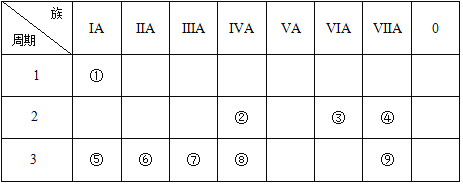
(1)表中用于半导体材料的元素在周期表中的位置__________。
(2)③、④、⑧的原子半径最小是__________(用元素符号回答)。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物,碱性最强的是________(用化学式回答)。
(4)②、③、④的气态氢化物,稳定性最强的是__________(用结构式回答)。
(5)②和③按原子数1:2形成的化合物的电子式为____,该晶体气化的过程中克服的微粒间作用力为______。
(6)③和⑧形成的化合物属于__________(填“离子化合物”或“共价化合物”),该晶体属于__________晶体(填“离子”、“分子”、“原子”)。
(7)元素⑤、⑦的最高价氧化物的水化物互相反应的离子方程式为:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究反应2X(g)![]() Y(g)+Z(g)的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度(molL-1)随反应时间(min)的变化情况如图所示。
Y(g)+Z(g)的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度(molL-1)随反应时间(min)的变化情况如图所示。

下列说法不正确的是
A. 比较实验②、④得出:升高温度,化学反应速率加快
B. 比较实验①、②得出:增大反应物浓度,化学反应速率加快
C. 若实验②、③只有一个条件不同,则实验③使用了催化剂
D. 在0~10min之间,实验②的平均速率v(Y)=0.04molL-1min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com