
利用如图所示装置进行下列实验,不能得出相应实验结论的是

选项 | ① | ② | ③ | 实验结论 |
A | 稀硫酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:S>C>Si |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
C | 浓硝酸 | Fe | NaOH溶液 | 说明铁和浓硝酸反应可生成NO2 |
D | 浓氨水 | 生石灰 | 酚酞 | 氨气的水溶液呈碱性 |
C
【解析】
试题分析:A、稀硫酸滴入碳酸钠中二者反应生成二氧化碳,二氧化碳与硅酸钠溶液反应生成硅酸沉淀,说明顺酸性:H2SO4>H2CO3>H2SiO3,非金属性:S>C>Si,能得出相应实验结论,错误;B、浓硫酸能使蔗糖脱水碳化,反应放热,浓硫酸在加热条件下与碳反应生成的二氧化硫能使溴水褪色,能得出实验结论。错误;C、常温下,浓硝酸使铁钝化,不能得出实验结论,正确;D、浓氨水与生石灰反应生成的氨气使酚酞变红,证明氨气的水溶液呈碱性,能得出实验结论,错误。
考点:考查化学实验方案的分析、评价。
考点分析: 考点1:综合性实验 考点2:非金属及其化合物 试题属性

科目:高中化学 来源:2014-2015四川省资阳市高二上学期学期期末化学试卷(解析版) 题型:填空题
(8分)恒容体系,发生如下反应2A(g) B(g)+xC(g) ΔH,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如图。某课外活动小组一共进行了如图所示的三个实验(其中T1、T2表示不同的反应温度)。
B(g)+xC(g) ΔH,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如图。某课外活动小组一共进行了如图所示的三个实验(其中T1、T2表示不同的反应温度)。

(1)在实验Ⅲ中,0~20min的时间内,v(A)= 。
(2)分析实验I和实验II的数据,可知x= ;分析实验II和实验Ⅲ的数据,可知反应热ΔH 0(选填“>”、“=”或者“<”)。
(3)能说明该反应达到平衡状态的是(选填代号字母) 。
a.A的质量不再变化
b.混合气体的密度保持不变
c.用A、B、C表示的反应速率的比为2∶1∶x
d.单位时间内生成n mol B的同时生成2n mol A
e.混合气体的平均摩尔质量保持不变
(4)T1℃时,保持容器的体积不变,若充入a mol A、b mol B、c mol C,达到平衡时C的体积分数为0.4,则a、b、c应满足什么条件 。
查看答案和解析>>
科目:高中化学 来源:2014-2015上海市高一上学期期末考试化学试卷(解析版) 题型:选择题
已知一个SO2分子的质量为n kg,一个SO3分子的质量为m kg(设两种分子中S、O原子分别具有相同的中子数),若以硫原子质量的1/32作标准,SO2的相对分子质量为
A. B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市石景山区高三一模理综化学试卷(解析版) 题型:选择题
用右图所示装置检验对应气体时,不能达到目的的是

生成的气体 | 试剂X | 试剂Y | |
A | 电石与水反应制取的乙炔 | CuSO4溶液 | Br2的CCl4溶液 |
B | 木炭与浓H2SO4加热制取的二氧化碳 | 饱和NaHCO3溶液 | 澄清石灰水 |
C | CH3CH2Br与NaOH乙醇溶液共热制取的乙烯 | 水 | KMnO4酸性溶液 |
D | C2H5OH与浓H2SO4加热至170℃制取的乙烯 | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市丰台区高三一模理综化学试卷(解析版) 题型:实验题
(14分)铁及其化合物在日常生活中有广泛应用。
(1)写出Fe(OH)2转化为Fe(OH)3的化学方程式 。
(2)绿矾(FeSO4·7H2O)是补血剂的原料,易变质。检验绿矾是否变质的试剂是
设计实验检验绿矾是否完全变质
(3)利用绿矾制备还原铁粉的工业流程如下:

①干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O在空气中被氧化为FeOOH,该反应的化学方程式为
②取干燥后的FeCO3样品12.49g ,焙烧,最终得到还原铁粉6.16g,计算样品中杂质FeOOH的质量
(4)以羰基化合物为载体运用化学平衡移动原理分离、提纯某纳米级活性铁粉(含有一些不反应的杂质),反应装置如下图。
Fe(s)+5CO(g)  Fe(CO)5(g) ΔH<0
Fe(CO)5(g) ΔH<0

T1 T2(填“>”、“<”或“=”),判断理由是
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三第二次模拟理综化学试卷(解析版) 题型:实验题
(15分)某合作学习小组的同学拟用硼砂制取硼酸并测定硼酸样品的纯度。制备硼酸的实验流程如下:

(1)溶解硼砂时需要的玻璃仪器有:烧杯和___________。
(2)用pH试纸测定溶液pH的操作方法为__________________________________。
(3)用盐酸酸化硼砂溶液生成硼酸的离子方程式为_________________________。
(4)实验流程中缺少的步骤a、步骤b操作分别为_________、_________。
(5)硼酸酸性太弱不能用碱的标准溶液直接滴定,实验室常采用间接滴定法,其原理为:

滴定步骤为:

①滴定到终点时溶液颜色变化是______________________________________。
②若滴定到终点时消耗NaOH标准溶液22.00mL,则本次滴定测得的硼酸样品中硼酸的质量分数为__________________(假定杂质不反应)。
③若滴定时滴定管尖嘴部分有气泡,滴定过程中消失,将导致测得的结果_____。(选填:“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三第二次模拟理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A. 的分子式为C17H24O3
的分子式为C17H24O3
B.结构为…—CH=CH—CH=CH—CH=CH—CH=CH—…的高分子化合物,其单体是乙炔
C.有机硅聚醚( )可由单体
)可由单体 和
和 缩聚而成
缩聚而成
D.等质量的甲醇、甲醛、甲醚完全燃烧时的耗氧量依次递增
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三下学期初考试理综化学试卷(解析版) 题型:填空题
氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5 kJ,则该反应的热化学方程式为 。
(2)298 K时,在2 L固定体积的密闭容器中,发生可逆反应:
2NO2(g) N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:

① 298k时,该反应的平衡常数为 L·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是 :
A.混合气体的密度保持不变;
B.混合气体的颜色不再变化;
C.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)=0.6 mol,n(N2O4)=1.2 mol,则此时V(正) V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。
现向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,

①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序 。
③d、e点对应溶液中,水电离程度大小关系是d e(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省汕头市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
(16分)CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)在一定条件下,CH4和CO2以镍合金为催化剂,发生反应:CO2(g)+CH4(g)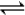 2CO(g)+2H2(g),其平衡常数为K,在不同温度下,K 的值如下:
2CO(g)+2H2(g),其平衡常数为K,在不同温度下,K 的值如下:

①从上表可以推断:该反应的逆反应是 (填“吸”、“放”)热反应。
②此温度下该反应的平衡常数表达式为K=__________________。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是_________。

②为了提高该反应中CH4的转化率,可以采取的措施是 。
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为 。
(3)Li2O、Na2O、MgO均能吸收CO2。
①如果寻找吸收CO2的其他物质,下列建议合理的是________。
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是__________________ _________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com