
 请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式
请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式| 104×92.3% |
| 12 |
| 104-12×8 |
| 1 |
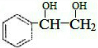 ,羟基与乙酸发生酯化反应;
,羟基与乙酸发生酯化反应;| 104×92.3% |
| 12 |
| 104-12×8 |
| 1 |
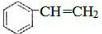 ,与溴发生加成反应生成
,与溴发生加成反应生成 ,则反应的方程式为
,则反应的方程式为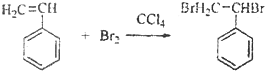 ,
, ;加成反应;
;加成反应; 可知生成
可知生成 ,
,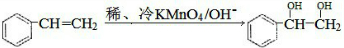 ,1mol
,1mol 最多能与2mol乙酸反应,
最多能与2mol乙酸反应,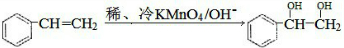 ;2;
;2; ,故答案为:
,故答案为: .
.


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将14.2 g Na2SO4溶于100 mL水中 |
| B、将14.2 g Na2SO4?10H2O溶于少量水中,再用水稀释至100 mL |
| C、将20 mL 5.0 mol?L-1 Na2SO4溶液用水稀释至100 mL |
| D、将50 mL 2.0 mol?L-1 Na2SO4溶液注入100 mL容量瓶中再加水至100 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
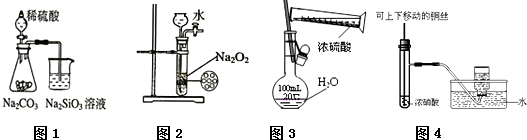
| A、图1为证明非金属性强弱:S>C>Si |
| B、图2为制备少量氧气 |
| C、图3为配制一定物质的量浓度的硫酸溶液 |
| D、图4为制备并收集少量NO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2NO2?N2O4 (正反应为放热反应) |
| B、C(s)+CO2?2CO (正反应为吸热反应) |
| C、N2+3H2?2NH3 (正反应为放热反应) |
| D、H2S?H2+S(S) (正反应为吸热反应) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com