
(15分)锌锰干电池所含的汞、酸或碱等在废弃后进入环境中将造成严重危害。对废旧电池进行资源化处理显得非常重要。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
(1)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为_________________________________________________________。
(2)填充物用60℃温水溶解,目的是加快溶解速率,但必须控制温度不能太高,其原因是___________。
(3)操作A的名称为_____________ 。
(4)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。其主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有___________mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出其反应的化学方程式:________________。
(5)铜帽溶解时加入H2O2的目的是_______________________________(用化学方程式表示)。铜帽溶解完全后,可采用_____________方法除去溶液中过量的H2O2。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:
根据上图可知:
①pH对Hg吸收率的影响规律是__________________________________________________.
②在强酸性环境下Hg的吸收率高的原因可能是_____________________________________.
(1)Zn+2OH--2e-=Zn(OH)2 (2)温度过高氯化铵受热分解 (3)过滤
(4)①4 ②2MnO(OH)+6HCl(浓)  2MnCl2+Cl2↑+4H2O
2MnCl2+Cl2↑+4H2O
(5)Cu+H2O2+H2SO4=CuSO4+2H2O 加热
(6)①随pH升高,汞的吸收率先降低后增加 ② KMnO4在酸性条件下氧化性强
解析试题分析:(1)根据已知条件可知该电池中的负极的电极式是Zn+2OH--2e-=Zn(OH)2。(2)为加快溶解速率填充物要用温水溶解,但温度不能太高,否则氯化铵受热分解。(3)把不溶性的固体与可溶性固体分离的操作是过滤。(4)①当1 mol MnO2参加反应时,共有4molC原子有反应前的+3价变为+4价。所以转移电子4mol。②根据电子守恒及质量守恒定律可得MnO(OH)与浓盐酸在加热条件下反应的化学方程式为2MnO(OH)+6HCl(浓)  2MnCl2+Cl2↑+4H2O。(5)铜帽溶解时加入H2O2的目的是为了溶解Cu单质。反应的方程式为Cu+H2O2+H2SO4=CuSO4+2H2O。铜帽溶解完全后,溶液中含有过量的H2O2。由于H2O2不稳定,受热容易发生分解反应产生氧气和水。所以可采用加热的方法除去溶液中过量的H2O2。(6)根据上图可知:①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率逐渐降低,当溶液的pH>11后又增加。即:先降低后升高。②在强酸性环境下Hg的吸收率高的原因可能是强酸性环境中KMnO4的氧化性强。
2MnCl2+Cl2↑+4H2O。(5)铜帽溶解时加入H2O2的目的是为了溶解Cu单质。反应的方程式为Cu+H2O2+H2SO4=CuSO4+2H2O。铜帽溶解完全后,溶液中含有过量的H2O2。由于H2O2不稳定,受热容易发生分解反应产生氧气和水。所以可采用加热的方法除去溶液中过量的H2O2。(6)根据上图可知:①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率逐渐降低,当溶液的pH>11后又增加。即:先降低后升高。②在强酸性环境下Hg的吸收率高的原因可能是强酸性环境中KMnO4的氧化性强。
考点:考查废电池中的各种资源回收利用及混合物的分离方法、物质的性质、方程式的书写的知识。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
(1)提高“反应l”反应速率的措施有______________(写出一条即可)。
(2)“反应2”的氧化剂是________,该反应的化学方程式为__________。
(3)采取“减压蒸发”而不用“常压蒸发”,原因是__________________。
(4)从 “母液”中可回收的主要物质是__________________________。
(5)“冷却结晶”后经_____________(填操作名称)即可获得粗产品。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
蓝铜矿主要含xCuCO3·yCu(OH)2,还含有少量Fe的化合物,工业上以蓝铜矿为原料制备Cu、CaCO3和CuSO4.5H2O。具体方法步骤如下:
已知:
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀 | 3.2 | 9.0 | 6.7 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下:
生成氢氧化物沉淀的pH
| | Mg(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 9.4 | 6.3 | 1.5 |
| 完全沉淀时 | 12.4 | 8.3 | 2.8 |
 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑ MgO+SO2↑+CO↑
MgO+SO2↑+CO↑  MgO+S↓+3CO↑
MgO+S↓+3CO↑
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:
(1)“酸浸”过程中主要反应的离子方程式为__________ 、____________。
(2)“酸浸”时铝浸出率的影响因素可能有_____ ________、_____ ______。(写出两个)
(3)物质X的化学式为___________。“碱溶”时反应的主要离子方程式为:Fe3++3OH- = Fe(OH)3↓; 。
(4)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4为了获得产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是 。
(5)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向AlCl3溶液中不断通入HCl气体,可析出大量AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
军用光敏材料KxFe(C2O4)y·3H2O(Fe为+3价)的实验室制备和测定其组成的方法如下所示:
Ⅰ.制备:
(1)用K2C2O4和FeCl3制备光敏材料的反应属于________(填序号)。
①离子反应 ②非氧化还原反应 ③氧化还原反应 ④化合反应
(2)结晶时应将饱和溶液放在黑暗处等待晶体的析出,这样操作的原因是_________。
(3)操作4的实验操作有____________。
Ⅱ.组成测定:
称取一定质量实验所得的晶体置于锥形瓶中,加足量蒸馏水和稀H2SO4,将C2O42-完全转化为H2C2O4,用0.10 mol·L-1 KMnO4溶液进行滴定,消耗KMnO4溶液24.00 mL时恰好完全反应(酸性条件下MnO4-的还原产物是Mn2+);再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液4.00 mL。
(4)高锰酸钾氧化H2C2O4和Fe2+的离子方程式分别是___________; ________。
(5)配制100 mL 0.10 mol·L-1 KMnO4溶液及在上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外,还有________和________(写名称)。
(6)通过计算,该化合物的化学式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为(MgCO3,舍少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
(1)通入O2氧化时,发生反应的离子方程式为____________________。
(2)滤渣2的成分是_________(填化学式)
(3)流程图中“操作步骤”为 、过滤等操作,得到MgSO4·7H2O晶体。对MgSO4·7H2O晶体直接加热 (填“能”或“不能”)得到无水MgSO4固体。
(4)长时间加热MgCO3悬浊液后生成Mg(OH)2,该反应的化学方程式为 。
(5)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
 2MgO+2SO2↑+CO2↑; MgSO4+C
2MgO+2SO2↑+CO2↑; MgSO4+C MgO+SO2↑+CO↑;
MgO+SO2↑+CO↑; MgO+S↑+3CO↑。
MgO+S↑+3CO↑。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上生产高氯酸(沸点:90°C)时还同时生产了亚氯酸钠,其工艺流程如下: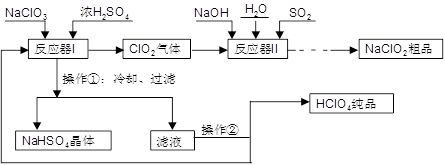
(1)实验室进行过滤操作的常用玻璃仪器有 。
(2)反应器I中的温度最佳为 (填序号);操作②的名称为 。
A. 0°C ; B. 20°C ; C. 80°C ; D. 120°C
(3)反应器II中发生反应的离子方程式为 。
(4)加快反应器II中反应速率的措施有 (写出一种措施即可)等。从反应器II中获得NaClO2 粗品的实验操作依次是 (填序号,下同),进一步提纯的操作名称为 。
A.过滤 B.重结晶 C.蒸馏 D.蒸发浓缩 E.蒸干灼烧 F.冷却结晶 G.萃取分液
(5)上述流程中可循环使用的物质为 ,副产品除NaClO2、NaHSO4外还有 (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
完成下列填空:
(1)氯碱工业主要以食盐为原料。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列操作,正确的操作顺序是 。
①过滤;②加过量的NaOH溶液;③加适量的盐酸;④加过量的Na2CO3溶液;⑤加过量的BaCl2溶液
a.②⑤④①③ b.①④②⑤③ c d.⑤②④①③
(2)在实验室中可以用萃取的方法提取溴,可选用的试剂是________________,所用主要仪器的名称是____________________。
(3)步骤Ⅰ中用硫酸酸化可提高Cl2利用率的原因是 。
(4)步骤II反应的离子方程式__________________________________________。
(5)海水提溴蒸馏过程中,温度应控制在80~90℃,温度过高或过低都不利于生产 ,请解释原因 。
(6)Mg(OH)2沉淀中混有Ca(OH)2,可选用__________溶液进行洗涤除去。如直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,你_______(选填“同意”,“不同意”)该说法,理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com