
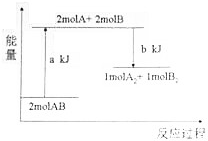
| A. | 该反应是放热反应 | |
| B. | 该反应一定要在加热条件下才能进行 | |
| C. | 断开lmolA2中的化学键和lmolB2中的化学键需吸收akJ的能量 | |
| D. | 1moIA2和1moIB2的总能量高于2molAB的总能量 |
分析 A、据图可知,反应物的总能量小于生成的总能量;
B、反应吸放热与反应条件无必然关系;
C、断开lmolA2中的化学键和lmolB2中的化学键需吸收的能量与形成lmolA2中的化学键和lmolB2中的化学键放出的能量相同;
D、根据图象分析.
解答 解:A、据图可知,反应物的总能量小于生成的总能量,故此反应吸热,故A错误;
B、此反应为吸热反应,而反应吸放热与反应条件无必然关系,即吸热反应不一定需要加热,故B错误;
C、断开lmolA2中的化学键和lmolB2中的化学键需吸收的能量与形成lmolA2中的化学键和lmolB2中的化学键放出的能量相同,而根据图象可知,由2molB原子和2molA原子形成lmolA2中的化学键和lmolB2中的化学键放出aKJ的能量,故断开lmolA2中的化学键和lmolB2中的化学键需吸收的能量为aKJ,故C正确;
D、根据图象可知,1moIA2和1moIB2的总能量高于2molAB的总能量,故D正确.
故选CD.
点评 本题考查学生有关化学反应中的能量变化知识,难度不大,注意基础知识的积累.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:解答题
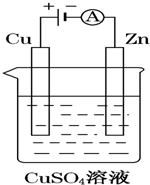 如图是一个电解过程示意图.
如图是一个电解过程示意图.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
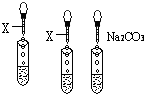 实验室有三瓶失去标签的无色溶液:氯化钾、氢氧化钙和稀硫酸,可用一种常见酸碱指示剂X 或Na2CO3一次鉴别它们.根据有关操作及所加试剂填空.
实验室有三瓶失去标签的无色溶液:氯化钾、氢氧化钙和稀硫酸,可用一种常见酸碱指示剂X 或Na2CO3一次鉴别它们.根据有关操作及所加试剂填空.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{\;}^{13}$O和14O互称同素异形体 | B. | 丙烷和异丁烷互称同系物 | ||
| C. | 金刚石和石墨互称同位素 | D. | 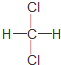 和 和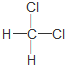 互称同分异构体 互称同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
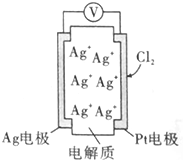 原电池的应用极为广泛.利用如下图所示原电池可测量空气中Cl2的含量,其中电解质是Ag+可以自由移动的固体物质,下列分析正确的是( )
原电池的应用极为广泛.利用如下图所示原电池可测量空气中Cl2的含量,其中电解质是Ag+可以自由移动的固体物质,下列分析正确的是( )| A. | 电流经外电路从Ag流向Pt电极 | |
| B. | 电池工作时,电解质中Ag+数目增多 | |
| C. | 正极反应:Cl2+2e-=2Cl- | |
| D. | 空气中c(Cl2)越大,Ag极消耗速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 | B. | 0.2 | C. | 0.3 | D. | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com