
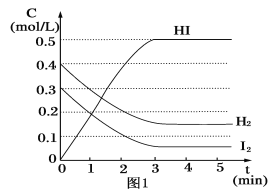
【题目】在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)![]() 2HI(g)ΔH=-QkJ/mol(Q>0),反应中各物质的浓度随时间变化情况如图1:
2HI(g)ΔH=-QkJ/mol(Q>0),反应中各物质的浓度随时间变化情况如图1:
(1)该反应的化学平衡常数表达式为__。
(2)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为__。
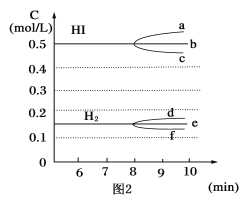
(3)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K__(填写增大、减小或不变)。HI浓度的变化正确的是__(用图2中a~c的编号回答)。
②若加入I2,H2浓度的变化正确的是__(用图2中d~f的编号回答)。
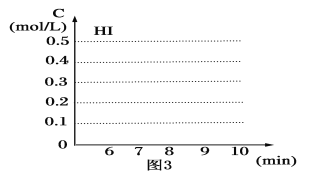
(4)反应达到平衡后,第8分钟时,若把容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况___。
【答案】K=![]() 0.167mol/(L·min) 减小 c f
0.167mol/(L·min) 减小 c f 
【解析】
(1)化学平衡常数=生成物浓度的系数次方的乘积÷反应物浓度系数次方的乘积;
(2)平均速率v(HI)=![]() ;
;
(3) H2(g)+I2(g)![]() 2HI(g) ΔH<0,升高温度平衡逆向移动;若加入I2,平衡正向移动;
2HI(g) ΔH<0,升高温度平衡逆向移动;若加入I2,平衡正向移动;
(4)反应前后气体系数和相等,若把容器的容积扩大一倍,浓度变为原来一半,平衡不移动;
(1)化学平衡常数=生成物浓度的系数次方的乘积÷反应物浓度系数次方的乘积,H2(g)+I2(g)![]() 2HI(g)反应的平衡常数表达式是K=
2HI(g)反应的平衡常数表达式是K=![]() 。
。
(2)平均速率v(HI)=![]() ,根据图1数据,反应开始至达到平衡时,平均速率v(HI)=
,根据图1数据,反应开始至达到平衡时,平均速率v(HI)=![]() = 0.167mol/(L·min);
= 0.167mol/(L·min);
(3)①H2(g)+I2(g)![]() 2HI(g) ΔH<0,升高温度平衡逆向移动,化学平衡常数K减小,升高温度,平衡逆向移动,HI浓度减小,选c;
2HI(g) ΔH<0,升高温度平衡逆向移动,化学平衡常数K减小,升高温度,平衡逆向移动,HI浓度减小,选c;
②若加入I2,平衡正向移动,H2浓度减小,选f。
(4)反应前后气体系数和相等,若把容器的容积扩大一倍,浓度变为原来一半,平衡不移动,HI浓度的变化情况是 ;
;


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关阿伏加德罗常数NA的叙述中不正确的是( )
A.1mol NaHSO4固体所含的阳离子数目为NA
B.常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA
C.标准状况下,22.4L HF含有电子数为8NA
D.60g石英晶体中含有的Si-O键数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以有机物A为原料合成聚合物PMA和聚碳酸酯PC的路线如下:

回答下列问题:
(1)下列关于高分子化合物的说法中正确的是________。(填标号)
a.聚乙烯分子中含有碳碳双键
b.![]() 的单体是2-丁炔
的单体是2-丁炔
c.棉花、羊毛和蚕丝是天然纤维
d.CuSO4溶液可使蛋白质变性
(2)A的化学名称是________,C中的官能团名称为_________。
(3)①的反应类型为________,③的反应类型为________。
(4)反应②的化学方程式为_____________________。
(5)B的同系物C5H8O2共有____________种同分异构体(不含立体异构),写出其中核磁共振氢谱为三组峰的物质的结构简式:______________。
(6)参照上述合成路线,以CH3CHO为原料(无机试剂任选),设计制备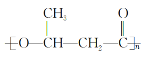 的合成路线________________。
的合成路线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有a~g7种短周期元素,它们在元素周期表中的相对位置如表所示,请回答下列问题:
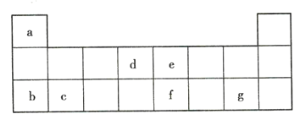
(1)下列选项中,元素的原子间最容易形成离子键的是___(填序号,下同),元素的原子间最容易形成共价键的是___。
A.c和f B.b和g C.d和g D.c和e
(2)下列由a~g7种元素原子形成的各种分子中,所有原子最外层都满足8电子稳定结构的是___(填序号)。
A.ea3 B.ag C.fg3 D.dg4
(3)由题述元素中的3种非金属元素形成的AB型离子化合物的电子式为___。
(4)c与e可形成一种化合物,试写出该化合物的化学式:___,其含有的化学键类型为___,其与过量稀盐酸反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑色冶金工业中除了铁、锰、铬、钒、钛以及这些金属的黑色金属合金以外,其他的金属,都算是有色金属。
![]() 基态钛原子的结构示意图为________;基态铬原子的价层电子排布式为________。
基态钛原子的结构示意图为________;基态铬原子的价层电子排布式为________。
![]() 中C、N的电负性关系为C________
中C、N的电负性关系为C________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() ;
;![]() 的沸点比
的沸点比![]() 的沸点低,其原因是________。
的沸点低,其原因是________。
![]() 中C原子的杂化方式为________;
中C原子的杂化方式为________;![]() 分子是________
分子是________![]() 填“极性”或“非极性”
填“极性”或“非极性”![]() 分子;
分子;![]() 分子中
分子中![]() 键与
键与![]() 键的数目之比为________。
键的数目之比为________。
![]() 金属锰的一种晶体为面心立方最密堆积,其晶胞中有________个锰原子,每个锰原子周围紧邻的锰原子有________个。
金属锰的一种晶体为面心立方最密堆积,其晶胞中有________个锰原子,每个锰原子周围紧邻的锰原子有________个。
![]() 因
因![]() 和
和![]() 外围有较多能量相近的空轨道,故能与一些分子或离子形成配合物。如图为普鲁士蓝配合物晶体结构的示意图
外围有较多能量相近的空轨道,故能与一些分子或离子形成配合物。如图为普鲁士蓝配合物晶体结构的示意图![]() 每两个立方体中,一个
每两个立方体中,一个![]() 在其中一个立方体中心,另一个则无
在其中一个立方体中心,另一个则无![]() ,其化学式是________。
,其化学式是________。
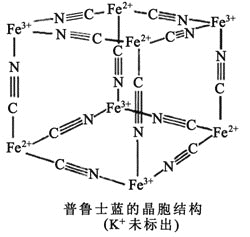
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 分别表示中学化学中常见的一种物质,它们之间的相互关系如图所示
分别表示中学化学中常见的一种物质,它们之间的相互关系如图所示![]() 部分反应物、生成物没有列出
部分反应物、生成物没有列出![]() ,且A、B、C、D、E、F六种物质中均含同一种元素.
,且A、B、C、D、E、F六种物质中均含同一种元素.
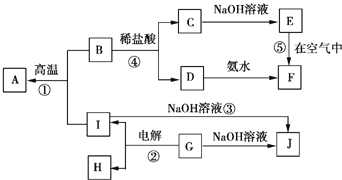
请填写下列空白:
![]() 、B、C、D、E、F六种物质中所含的同一种元素在周期表中的位置为 ______ .
、B、C、D、E、F六种物质中所含的同一种元素在周期表中的位置为 ______ .
![]() 反应
反应![]() 阳极的电极反应式为 ______ ,反应
阳极的电极反应式为 ______ ,反应![]() 的离子方程式为 ______ ,反应
的离子方程式为 ______ ,反应![]() 的化学方程式为 ______ .
的化学方程式为 ______ .
![]() 实验室配制C溶液时通常要加入少量的 ______ ;将少量D的浓溶液滴入沸水中得到的液体呈 ______ 色,再逐滴滴加盐酸时,产生的现象是 ______ ;
实验室配制C溶液时通常要加入少量的 ______ ;将少量D的浓溶液滴入沸水中得到的液体呈 ______ 色,再逐滴滴加盐酸时,产生的现象是 ______ ;
![]() 反应
反应![]() 中每生成3molA,转移电子的物质的量为 ______ .
中每生成3molA,转移电子的物质的量为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
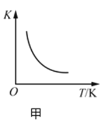
【题目】根据下列图示所得出的结论正确的是
A.图甲表示反应![]() 的平衡常数K与温度的关系,说明该反应的
的平衡常数K与温度的关系,说明该反应的![]()
B.图乙表示Cu与过量浓硝酸反应生成的![]() 气体体积随时间的变化关系,说明该反应在
气体体积随时间的变化关系,说明该反应在![]() 时间段内反应速率最快
时间段内反应速率最快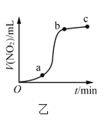
C.图丙表示一定温度下![]() 和NiS的沉淀溶解平衡曲线,说明该温度下,
和NiS的沉淀溶解平衡曲线,说明该温度下,![]() 时,两者的
时,两者的![]() 相等
相等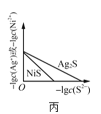
D.图丁表示相同温度下,![]() 的HF和
的HF和![]() 溶液分别加水稀释时pH的变化曲线,说明加水稀释前HF的电离程度大于
溶液分别加水稀释时pH的变化曲线,说明加水稀释前HF的电离程度大于![]() 的电离程度
的电离程度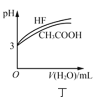
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前世界上60%的镁是从海水中提取的。已知海水提取镁的主要步骤如图:
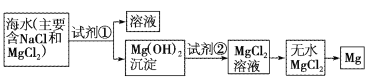
(1)关于加入试剂①作沉淀剂,有以下几种不同方法,请完成下列问题。
方法 | 是否正确 | 简述理由 |
方法1:直接往海水中加入沉淀剂 | 不正确 | 海水中镁离子浓度小,沉淀剂的用量大,不经济 |
方法2:高温加热蒸发海水后,再加入沉淀剂 | 不正确 | (一) |
你认为最合理的其他方法是:(二) | ||
(一)___;
(二)___;
(2)框图中加入的试剂①应该是___(填化学式);加入的试剂②是___(填化学式);工业上由无水MgCl2制取镁的化学方程式为___。
(3)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com