
【题目】某温度T1时,向容积为2L的恒容密闭容器中充入一定量的H2和I2(g),发生反应:H2(g)+I2(g) ![]() 2HI(g),反应过程中测定的部分数据见下表(表中t2>t1)。下列说法正确的是
2HI(g),反应过程中测定的部分数据见下表(表中t2>t1)。下列说法正确的是
反应时间/min | n(H2)/mol | n(I2)/mol |
0 | 0.9 | 0.3 |
t1 | 0.8 | |
t2 | 0.2 |
A. 反应在tmin内的平均速率为:v(H2)=![]() mol-1·L-1·min-l
mol-1·L-1·min-l
B. 保持其他条件不变,向平衡体系中再通0.20molH2,与原平衡相比,达到新平衡时I2(g)转化率增大,H2的体积分数不变
C. 保持其他条件不变,起始时向容器中充入的H2和I2(g)都为0.5mol,达到平衡时 n(HI)=0.2mol
D. 升高温度至T2时,上述反应平衡常数为0.18,则正反应为吸热反应
【答案】C
【解析】A.根据v=![]() 进行计算;B.恒温恒压,增加一种反应物浓度可以提高另一种反应物的转化率,自身的体积分数增大;C.平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,结合平衡三段式计算平衡常数,再根据平衡常数计算平衡时HI的物质的量;D.平衡常数减小,平衡逆向移动,依此进行判断。
进行计算;B.恒温恒压,增加一种反应物浓度可以提高另一种反应物的转化率,自身的体积分数增大;C.平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,结合平衡三段式计算平衡常数,再根据平衡常数计算平衡时HI的物质的量;D.平衡常数减小,平衡逆向移动,依此进行判断。
A.由表中数据可知,t1min内参加反应的H2的物质的量为0.9mol-0.8mol=0.1mol,故v(H2)=![]() =
=![]() =
=![]() mol/(Lmin),故A错误;
mol/(Lmin),故A错误;
B.保持其他条件不变,向平衡体系中再通入0.20molH2,与原平衡相比,H2的体积分数增大;H2的浓度增大,平衡正向移动,故I2(g)转化率增大,故B错误;
C.t1时, H2(g) + I2(g)2HI(g)
起始(mol) 0.9 0.3 0
转化(mol) 0.1 0.1 0.2
平衡(mol) 0.8 0.2 0.2
平衡常数K=![]() =
=![]() =0.25,
=0.25,
t2时, H2(g)+I2(g)2HI(g)
起始(mol) 0.5 0.5 0
转化(mol) x x 2x
平衡(mol)0.5-x 0.5-x 2x
K=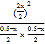 =0.25,解得x=0.1mol,故平衡时n(HI)=0.1mol×2=0.2mol,故C正确;
=0.25,解得x=0.1mol,故平衡时n(HI)=0.1mol×2=0.2mol,故C正确;
D.升高温度至T2时,上述反应平衡常数为0.18<0.25,说明升高温度,平衡逆向移动,故正反应为放热反应,故D错误;故选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】20℃时,饱和NaCl溶液的密度为ρg·cm-3,物质的量浓度为cmol·L-1则下列说法中错误的是( )
A.温度低于20℃时,饱和NaCl溶液的浓度小于cmol·L-1
B.20℃时,饱和NaCl溶液的质量分数为![]()
C.20℃时,密度小于ρg·cm-3的NaCl溶液是不饱和溶液
D.20℃时,饱和NaCl溶液的溶解度![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用人工模拟光合作用合成甲酸的原理为:2CO2+2H2O![]() 2HCOOH+O2,装置如图所示,下列说法不正确的是( )
2HCOOH+O2,装置如图所示,下列说法不正确的是( )

A. 电子由电极1经过负载流向电极2
B. 若将质子膜换成阴离子交换膜,该电池依然能够正常工作
C. 电极2的反应式:CO2+2H++2e﹣=HCOOH
D. 该装置能将太阳能转化为化学能和电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 1.8 g H218O与D2O的混合物中所含中子数为NA
B. 16.9g过氧化钡(BaO2)固体中阴、阳离子总数为0.3NA
C. 标准状况下的33.6 mL氯气通入足量水中,转移电子数为1.5×10-3 NA
D. 在5 NH4NO3 ![]() 2 HNO3+4 N2↑+9 H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
2 HNO3+4 N2↑+9 H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用括号中的试剂和方法除去各组物质中的少量杂质正确的是
A.甲苯中的苯酚(溴水、过滤)B.乙酸乙酯中的乙酸(NaOH溶液、分液)
C.乙醇中的乙酸(NaOH溶液、分液)D.乙醇中的水(新制的CaO、蒸馏)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s) + H2O(g)==CO(g)+H2(g) ΔH1=a kJmol-1
②CO(g) + H2O(g)==CO2(g)+H2(g) ΔH2=b kJmol-1
③CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH3 =c kJmol-1
④2CH3OH(g) ==CH3OCH3(g)+H2O(g) ΔH4=d kJmol-1
A. 反应①②为反应③提供原料气
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)== ![]() CH3OCH3(g)+
CH3OCH3(g)+ ![]() H2O(1)的ΔH =
H2O(1)的ΔH =![]() kJmol-1
kJmol-1
D. 反应 2CO(g)+4H2(g) ==CH3OCH3(g)+H2O(g)的ΔH= (2b+2c+d) kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25 ℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴加5 mL盐酸于试管中。

试回答下列问题:
(1)实验中观察到的现象是______________________________。
(2)产生上述现象的原因是______________________________。
(3)写出有关反应的离子方程式:_______________________。
(4)由实验推知,镁片和盐酸的总能量________(填“大于”“小于”或“等于”)氯化镁溶液和氢气的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.钠着火可用干燥的沙土来灭火
B.氯化钠溶于水,在通电条件下才能发生电离
C.金属材料包括纯金属和它们的合金
D.分散质粒子的直径为1~100nm的分散系是胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若aAm+和bBn-的核外电子排布相同,则下列关系中不正确的是( )
A. 离子半径Am+<Bn-B. A的质子数比B的质子数多(m+n)
C. 原子半径A < BD. A在元素周期表中位于B的下一周期
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com