
【题目】如图所示,把试管放入盛有25 ℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴加5 mL盐酸于试管中。

试回答下列问题:
(1)实验中观察到的现象是______________________________。
(2)产生上述现象的原因是______________________________。
(3)写出有关反应的离子方程式:_______________________。
(4)由实验推知,镁片和盐酸的总能量________(填“大于”“小于”或“等于”)氯化镁溶液和氢气的总能量。
【答案】镁片上有大量气泡产生镁片逐渐溶解烧杯内石灰水出现浑浊现象 镁与盐酸反应产生氢气,该反应是放热反应,而Ca(OH)2在水中的溶解度随温度的升高而减小,从而石灰水中有Ca(OH)2析出而变浑浊 Mg+2H+=Mg2++H2↑ 大于
【解析】
在如图所示的实验中,向试管内滴入稀盐酸,盐酸与镁剧烈反应放出氢气,同时反应放出的热量使饱和石灰水溶液温度升高,温度升高氢氧化钙溶解度减小,饱和溶液析出固体氢氧化钙而使溶液看上去变浑浊。
(1)把试管放入盛有25 ℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴加5 mL盐酸于试管中,由于Mg是比较活泼的金属,与盐酸会发生反应:Mg+2HCl=MgCl2+H2↑,镁条与盐酸反应生成氢气,产生大量气泡,Mg由于反应而不断溶解、消耗,该反应是放热反应,由于氢氧化钙的溶解度随温度的升高而减小,因此溶液温度升高,导致Ca(OH)2溶解度减小,使澄清的石灰水变浑浊因此观察到的现象是:镁片上有大量气泡产生镁片逐渐溶解烧杯内石灰水出现浑浊现象;
(2)产生上述现象的原因是镁与盐酸反应产生氢气,该反应是放热反应,而Ca(OH)2在水中的溶解度随温度的升高而减小,从而石灰水中有Ca(OH)2析出而变浑浊;
(3)镁与盐酸发生置换反应,生成氯化镁和氢气,反应为Mg+2HCl═MgCl2+H2↑,将其改写为离子方程式为Mg+2H+=Mg2++H2↑;
(4)镁条与盐酸反应为放热反应,说明反应物Mg与盐酸的能量和大于生成物MgCl2溶液和H2的总能量。


科目:高中化学 来源: 题型:
【题目】2000多年前,希腊生理学家和医学家希波克拉底发现,杨树、柳树的皮、叶中含有能镇痛和退热的物质。1800年,人们开始从该类植物中提取药物的活性成分——水杨酸(![]() )。1853年,德国化学家柯尔柏合成了水杨酸,并于1859年实现工业化生产。水杨酸虽然解热和镇痛效果很好,但由于酚羟基的存在,对肠道和胃粘膜有强烈的刺激,易引发呕吐和胃出血,而且味道令人生厌。1898年,德国化学家霍夫曼利用反应:
)。1853年,德国化学家柯尔柏合成了水杨酸,并于1859年实现工业化生产。水杨酸虽然解热和镇痛效果很好,但由于酚羟基的存在,对肠道和胃粘膜有强烈的刺激,易引发呕吐和胃出血,而且味道令人生厌。1898年,德国化学家霍夫曼利用反应:

制得乙酰水杨酸(阿司匹林),改善了水杨酸的疗效。1899年,由德国拜尔公司开始生产,并应用于临床,是第一种重要的人工合成药物。现代医药发展方向之一是合成药物长效化和低毒化,其有效途径是低分子药物高分子化,如:可将药物分子连在安全无毒的高分子链上。1982年,科学家通过乙二醇的桥梁作用把阿司匹林连接在高聚物上,制成缓释长效阿司匹林( ),用于关节炎和冠心病的辅助治疗。缓释长效阿司匹林分为高分子载体、低分子药物和作为桥梁作用的乙二醇三部分,在肠胃中水解变为阿司匹林,缓释长效阿司匹林使这种“古老”的解热镇痛药物重新焕发了“青春”。
),用于关节炎和冠心病的辅助治疗。缓释长效阿司匹林分为高分子载体、低分子药物和作为桥梁作用的乙二醇三部分,在肠胃中水解变为阿司匹林,缓释长效阿司匹林使这种“古老”的解热镇痛药物重新焕发了“青春”。
根据上述材料,结合所学知识,回答以下问题。
(1)水杨酸具有________和________的作用。
(2)霍夫曼制取阿司匹林的反应类型是________。
(3)在霍夫曼制取阿司匹林的反应中,可用于检验水杨酸是否完全反应的试剂是________。
(4)写出缓释阿司匹林在肠胃中水解出阿司匹林的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是
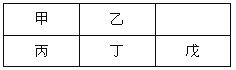
A. 原子半径:丙<丁<戊B. 金属性:甲>丙
C. 氢氧化物碱性:丙>丁>戊D. 最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度T1时,向容积为2L的恒容密闭容器中充入一定量的H2和I2(g),发生反应:H2(g)+I2(g) ![]() 2HI(g),反应过程中测定的部分数据见下表(表中t2>t1)。下列说法正确的是
2HI(g),反应过程中测定的部分数据见下表(表中t2>t1)。下列说法正确的是
反应时间/min | n(H2)/mol | n(I2)/mol |
0 | 0.9 | 0.3 |
t1 | 0.8 | |
t2 | 0.2 |
A. 反应在tmin内的平均速率为:v(H2)=![]() mol-1·L-1·min-l
mol-1·L-1·min-l
B. 保持其他条件不变,向平衡体系中再通0.20molH2,与原平衡相比,达到新平衡时I2(g)转化率增大,H2的体积分数不变
C. 保持其他条件不变,起始时向容器中充入的H2和I2(g)都为0.5mol,达到平衡时 n(HI)=0.2mol
D. 升高温度至T2时,上述反应平衡常数为0.18,则正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验不能达到预期实验目的的是
序号 | 实验内容 | 实验目的 |
A. | 将2.5g CuSO4·5H2O溶解在97.5g 水中 | 配制质量分数为1.6%的CuSO4溶液 |
B. | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
C. | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种更难溶的沉淀 |
D. | 分别向2支试管中加入5mL4%、5mL12%的过氧化氢溶液,再各加入几滴0.2mol·L-1FeCl3溶液 | 研究浓度对反应速率的影响 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应A+3B=2C+2D在四种不同情况下的反应速率分别为:
①v(A)=0.15 mol/(L·s); ②v(B)=0.6 mol/(L·s);
③v(C)=0.4 mol/(L·s); ④v(D)=0.45 mol/(L·s)。
该反应进行的快慢顺序为________________。
(2)某温度时,在2L容器中X、Y、Z三种物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式为_______________________。反应开始至2min,Z的平均反应速率为_______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加徳罗常数的数値,下列说法正确的是( )
A. 常温常圧下,7.0g由丁烯与丙烯組成的混合气体中含有的氢原子数目为NA
B. 向1L的密闭容器中充入46gNO2气体,容器中气体的分子数为NA
C. 6.4g铜与足量的硫单质混合加热,转移电子的数目为0.2NA
D. 标准状况下,2.24LSO3中含有0.1NA个SO3分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式书写正确的是( )
A. CH2=CH2 +Br2→CH3CHBr2
B. 2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
C. CH3COOH+CH3CH2OH![]() CH3COOCH3CH2+H2O
CH3COOCH3CH2+H2O
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”的主要内容之一是指从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物。下列化学反应符合“绿色化学”理念的是
A. 制CuSO4:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
B. 制CuSO4:2Cu+O2=2CuO;CuO+H2SO4(稀)=CuSO4+H2O
C. 制Cu(NO3)2:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
D. 制Cu(NO3)2:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com