
【题目】关于NaHCO3的性质,下列说法正确的是
A. 热稳定性比Na2CO3大
B. 相同温度下溶解度比Na2CO3要大
C. NaHCO3只能和酸作用不能和碱作用
D. 和酸反应放出等量的CO2所消耗的酸比Na2CO3少
【答案】D
【解析】
A.NaHCO3不稳定,加热易分解:2NaHCO3 ![]() Na2CO3+CO2↑+H2O,碳酸钠稳定,受热不分解,A错误;
Na2CO3+CO2↑+H2O,碳酸钠稳定,受热不分解,A错误;
B.常温下,向饱和碳酸钠溶液中通入二氧化碳气体,有碳酸氢钠晶体析出,可知常温时水溶解性:Na2CO3>NaHCO3,B错误;
C.NaHCO3可与酸反应生成二氧化碳气体,如与盐酸反应生成二氧化碳、氯化钠和水,也可与碱反应,如与氢氧化钠反应生成碳酸钠和水,C错误;
D.分别滴加HCl溶液,反应离子方程式为CO32-+2H+=CO2↑+H2O,HCO3-+H+=H2O+CO2↑,可见:和酸反应放出等量的CO2所消耗的酸NaHCO3比Na2CO3少,D正确;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】如图表示A~E五种物质间的相互转化关系,其中A为淡黄色固体,B为单质。回答下列问题:

(1)写出各物质的化学式:A.___,B.___,C.____,D.____,E.____。
(2)写出B→C、D→E反应的离子方程式:
B→C:____________________________________________________________;
D→E:____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炭跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是

A. 洗气瓶中产生的沉淀有碳酸钡
B. Z导管口无红棕色气体出现
C. 洗气瓶中产生的沉淀是亚硫酸钡
D. Z导管出来的气体中有二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与预期实验目的或实验结论一致的是( )
选项 | 实验操作及现象 | 实验目的或结论 |
A | 向Fe(NO3)2溶液中滴入用H2SO4酸化的H2O2溶液,则溶液变黄 | 氧化性:H2O2>Fe3+ |
B | 向某溶液加入HCl酸化的BaCl2溶液有沉淀产生 | 说明此溶液中一定含SO42﹣ |
C | 向Na2SiO3溶液中通入CO2出现浑浊 | 非金属性强弱:C>Si |
D | 向2 mL 0.1 mol·L-1 Na2S溶液中滴入几滴0.1 mol·L-1 ZnSO4溶液,有白色沉淀生成;再加入几滴0.1mol·L-1 CuSO4溶液,则又有黑色沉淀生成 | 溶度积(Ksp):ZnS>CuS |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).

已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表.
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | ﹣0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是______.
(2)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:______.
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过______;废渣中的主要成分除了LiF外,还有______.
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是______.
(5)在空气中加热5.49g草酸钴晶体(CoC2O42H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
890~920 | 2.25 |
①加热到210℃时,固体质量减轻的原因是______.
②经测定,加热到210~290℃过程中的生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为:____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,C和H2O(g)在密闭容器里发生下列反应:
①C(s)+H2O(g)![]() CO(g)+H2(g), ②CO(g)+H2O(g)
CO(g)+H2(g), ②CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
当反应达到平衡时,c(H2)=1.9 mol·L-1,c(CO)=0.1 mol·L-1。则下列叙述正确的有
A. CO在平衡时转化率为10%
B. 平衡浓度c(CO2)=c(H2)
C. 平衡时气体平均相对分子质量约为23.3
D. 其他条件不变时,缩小体积,H2O(g)的转化率随之降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨与硝酸都是氮的重要化合物,在工农业生产中有广泛应用。回答下列问题。
(1)氨气的制备
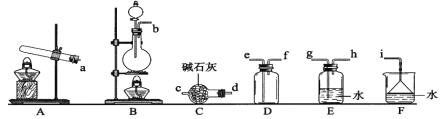

①氨气制取的发生装置可以选择上图中的_________(填字母),反应的化学方程式为__________。
②选择上图装置组装一套实验装置来收集一瓶干燥的氨气,所选装置的连接顺序为:发生装置→______→______,______→_____→i(按气流方向,用小写英文字母表示)。
③可用如右装置进行氨的喷泉实验,引发喷泉的操作是__________。
(2)如图所示,NH3经一系列反应可以得到HNO3。

①反应①的化学方程式为__________________________。
②产物NO是大气污染物之一。在400℃左右且有催化剂存在的情况下,可用氨将一氧化氮还原为无色无毒气体。该反应的化学方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题目要求回答问题
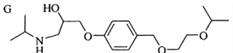
(1)写出该物质的分子式为___________写出该有机物中含氧官能团的名称_________
(2)已知某有机物的结构简式如图所示,写出同时符合下列两项要求的同分异构体的结构简式。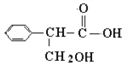
①化合物是1,3,5-三取代苯
②苯环上的三个取代基分别是甲基、羟基和含有酯基结构的基团。
____________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com