
【题目】实验室制备1,2-二溴乙烷的反应原理如下:
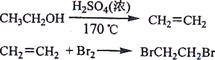
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l 40℃脱水生成乙醚。
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:

有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | 一l30 | 9 | -1l6 |
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高170℃左右,其最主要目的是 ;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用 洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用 的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是 。
【答案】(1) d (2) c (3)溴的颜色完全褪去
(4)下 (5) b (6)蒸馏 (7)避免溴大量挥发
【解析】
试题分析:(1)乙醇在浓硫酸140℃的条件下,发生分子内脱水,生成乙醚,答案选d;
(2)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应,答案选c;
(3)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色;
(4)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,产物在下层;
(5)常温下Br2和氢氧化钠发生反应:2NaOH+Br2═NaBr+NaBrO+H2O,答案选b;
(6)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离;
(7)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却。


科目:高中化学 来源: 题型:
【题目】下图是向MgCl2、A1C13混合溶液中先滴加试剂A,然后改滴试剂B,所得沉淀的物质的量y(mol)与试剂体积V(ml)间的关系,以下结论不正确的是

A. 原混合液中,c(A13+)︰c(Mg2+)︰c(c1)=1︰1︰5
B. 若A和B为一元强碱和一元强酸,则滴加7.5mL剂A后改滴试剂B
C. 若A是NaOH,B是盐酸,则c(NaOH)︰c(HC1)=2︰1
D. 从6到9,相应离子反应方程式H++OH—===H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组实验:①除去混在植物油中的水;②回收碘的CCl4溶液中的CCl4;③用食用酒精浸泡中草药提取其中的有效成分。以上实验采用的正确方法依次是( )
A.分液、萃取、蒸馏
B.萃取、蒸馏、分液
C.分液、蒸馏、萃取
D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如右图转化关系(部分生成物和反应条件略去)

下列推断不正确的是( )
A. 若X是Na2CO3,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
B. 若A是单质,B和D的反应是OH-+HCO3-=H2O+CO32-,E一定能还原Fe2O3
C. 若D为CO,C能和E反应,则A一定为Na2O2,其电子式是![]()
D. 若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地曾发生误食工业用猪油的中毒事件,调查原因是工业品包装中混入有机锡等,下列有关叙述正确的是( )
A. 猪油是天然有机高分子化合物
B. 猪油是高级脂肪酸甘油酯
C. 猪油发生皂化反应,反应液使蓝色石蕊试纸变红
D. 猪油皂化反应完全后,反应液静置分为两层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,用相关化学用语回答下列问题:
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | A | B | C | D | ||||
3 | E | F | G | H | I | J | K | L |
(1)写出H、I两种元素的名称_____________、_____________。
(2)这些元素的气态氢化物中最稳定的是________________,元素A的最高价氧化物的分子式为____________,属于______________化合物(填离子或共价);
其电子式为_______________;其结构式为_______________。
(3)从E到K的元素中,______原子半径最小。元素E和J形成的化合物属于_______化合物(填离子或共价)
(4)试用实验证明E和F的金属性的强弱(简述实验内容和结论)_____________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
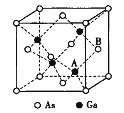
【题目】砷化稼(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)基态Ga原子的核外电子排布式为[Ar]_______________。
(2)根据元素周期律,元素的电负性Ga______(填“大于”或“小于”, 下同)As,第一电离能B ____ Ga;BF3和NH3的分子能够通过配位键相结合的原因是_______。
(3)杀虫剂Na3AsO4中阴离子的空问构型为______,As原子采取________杂化。
(4)组成相似的GaF3和GaCl3晶体,前者属于离子晶体,后者属于分子晶体。从F-和Cl-结构的不同分析其原因是____________。
(5)原子晶体GaAs的晶胞参数a=xpm,它的晶胞结构如下图所示。该晶胞内部存在的共价健数为______;A原子距离B原子所在六面体的侧面的最短距离为______ (用x表示)pm ;该晶胞的密度为_____g·cm-3。(阿伏伽德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
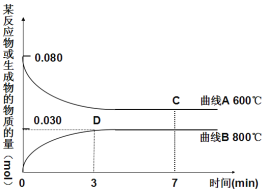
【题目】在2L密闭容器,800℃时发生如下反应:
2CuO(s)+CO(g)![]() Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
n(CuO)(mol) | 0.080 | 0.060 | 0.040 | 0.020 | 0.020 | 0.020 |
(1)写出该反应的平衡常数表达式 。
已知:K(400℃)>K(350℃),则该反应是 热反应。
(2)右图中表示Cu2O的物质的量随时间变化的曲线是 (选填“A”或“B”),800℃时,0~3min内该反应的平均速率v (CO2)= 。
(3) 能说明该反应已达到平衡状态的是 。
a.v(CO)=v(CO2) b.容器内压强保持不变
c.v逆(CO)=v正(CO2) d.容器内气体的密度保持不变
(4)能使该反应的正反应速率增大,且平衡向正反应方向移动的是 。
A.增加CuO的量
B.适当升高温度
C.及时移去CO2
D.增大CO的浓度
E.选择高效催化剂
F.增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com