
【题目】钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。下列说法不正确的是( )
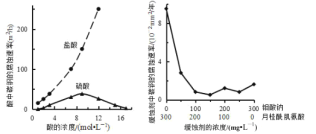
A.盐酸的浓度越大,腐蚀速率越快
B.钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
C.碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比
D.对比盐酸和硫酸两条曲线,可知 Cl-也会影响碳素钢的腐蚀速率
【答案】C
【解析】
A. 由图可知,酸的浓度越大,腐蚀速率越大,A正确;
B. 根据图示可知,当钼酸钠、月桂酰肌氨酸浓度相等时,腐蚀速率最小,缓蚀效果最优,B正确;
C. 碳素钢的腐蚀速率不随硫酸的浓度增大而增大,是由于在硫酸浓度很多时,硫酸主要以H2SO4的形式存在,具有强的氧化性,Fe被浓硫酸氧化,在金属表面产生一层致密的氧化物保护膜,阻止金属的进一步氧化,即发生钝化,与溶液中c(H+)大小无关,C错误;
D. 对比盐酸和硫酸两条曲线,发现碳钢在盐酸中的腐蚀速率明显快于硫酸的腐蚀速率,说明Cl-有助于碳素钢的腐蚀速率,而SO42-不利用碳素钢的腐蚀速率,D正确;
故合理选项是C。


 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】锂离子电池己被广泛用作便携式电源。正极材料为LiCoO2、LiFePO4等,负极材料一般为石墨碳,以溶有LiPF6、LiBF4等的碳酸二乙酯(DEC)作电解液。
(1)Fe2+基态核外电子排布式为 ________。
(2)PO43-的空间构型为 ________ (用文字描述)。
(3)![]() 中
中![]() 的配位数为6,该配合物中的配位原子为 _____。
的配位数为6,该配合物中的配位原子为 _____。
(4)碳酸二乙酯(DEC)的分子结构如图所示,分子中碳原子的轨道杂化类型为_____,1mol碳酸二乙酯(DEC)中含有σ键的数目为_____。
![]()
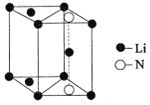
(5)氮化锂是一种新型无机贮氢材料,其晶胞结构如图所示,该晶体的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化镁溶液的密度为1.18 g·cm-3,其中镁离子的质量分数为5.1%,该溶液中氯离子的物质的量浓度为( )
A.0.5 mol·L-1B.2 mol·L-1
C.2.5 mol·L-1D.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列有机化合物的说法正确的是( )
A.![]() 、
、![]() 、
、![]() 互为同系物
互为同系物
B.有机化合物 的名称是2,3,5,5-四甲基-4-乙基己烷
的名称是2,3,5,5-四甲基-4-乙基己烷
C.有机化合物![]() 中最多有16个原子共面
中最多有16个原子共面
D.含有5个碳原子的饱和链烃,其一氯取代物有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列有机化合物的说法正确的是( )
A.![]() 、
、![]() 、
、![]() 互为同系物
互为同系物
B.有机化合物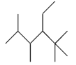 的名称是2,3,5,5-四甲基-4-乙基己烷
的名称是2,3,5,5-四甲基-4-乙基己烷
C.有机化合物![]() 中最多有16个原子共面
中最多有16个原子共面
D.含有5个碳原子的饱和链烃,其一氯取代物有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。

下列说法正确的是( )
A. 沸点A2D<A2X
B. CA3分子是非极性分子
C. C形成的单质中σ键与π键个数之比为1∶2
D. B、C、D形成的气态氢化物互为等电子体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废渣的主要成分为 SiO2、FeO、MgO,对其进行处理以回收废渣中的金属元素。25℃时,金属离子的物质的量浓度的负对数(-lg c)与溶液pH的关系如图所示(一般离子浓度 c≤10-5mol/L时,即认为该离子在溶液中不存在)。下列有关说法不正确的是
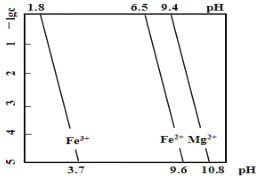
A.分离废渣中的SiO2,可以用过量的盐酸充分反应后过滤
B.可以用氯水将Fe2+氧化成Fe3+以便于铁元素与镁元素的分离
C.沉淀金属元素的顺序是先沉淀镁元素再沉淀铁元素
D.用 NaOH 调节pH沉淀铁元素时,pH应控制略大于3.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸分别和三种钠盐反应,下列分析正确的是

A. 对比①和②可以说明还原性Br->Cl-
B. ①和③相比可说明氧化性Br2>SO2
C. ②中试管口白雾是HCl遇水蒸气所致,说明酸性H2SO4>HCl
D. ③中浓H2SO4被还原成SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家哈伯在合成氨方面的研究促进了人类的发展。合成氨的工业流程如图,下列说法错误的是

A.增大压强既可以加快反应速率,又可以提高原料转化率
B.升高温度可提高平衡转化率
C.冷却过程中采用热交换有助于节约能源
D.原料循环可提高其利用率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com