
����Ŀ����ѧ��������������������ɳ�����չ������ء�����˵������ȷ����( )
A���⻯ѧ�����ǵ��������������������������е�һЩ̼�⻯�������ú����ɵ�һ���ж�����
B����ú����������ú�ĵ��������ȼ�ϸ��칤�������ڼ�����������
C����ɫ��ѧ�ĺ�����Ӧ�û�ѧԭ���Ի�����Ⱦ��������
D������ɻ���ʹ�õĸ����մ������������̼��ά����ǿ��������ϲ���

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������0.1000 mol/L NaOH��Һ�ֱ�ζ�20.00 mL 0.1000 mol/L HCl��Һ��20.00 mL 0.1000 mol/L CH3COOH��Һ���õ�2���ζ����ߣ�����ͼ��ʾ��

ͼ1 ͼ2
��1��CH3COOH�ĵ��뷽��ʽ�� ��
��2����A��C���жϣ��ζ�HCl��Һ�������� ���ͼ1����ͼ2������ͼ����a = mL��
��3����NaOH��Һ�ζ�CH3COOHʱѡ�� ��ָʾ������V(NaOH)=10.00 mLʱ���ζ�CH3COOH������Һ�е������غ�ʽ�� ��
��4��D����ʾ��Һ��c(Na+) c(CH3COO��)���������������������������
��5��E���Ӧ����ҺpH��7��ԭ���� �������ӷ���ʽ��ʾ������Һ������Ũ���ɴ�С��˳��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͨ�����з�ɢϵʱ���ܲ��������ЧӦ����
A. ������Һ B. ���۽��� C. ��������Һ D. ʳ��ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڽӴ���������������У�SO2ת����SO3ת���ʵĴ�Сֱ�Ӿ�������Ч�ʡ�ij�о�С������ͼװ��ģ�����������вⶨSO2ת����SO3��ת���ʡ���֪SO3���۵���16.8�棬�е���44.8�档����װ�������漰��Ӧ�Ļ�ѧ����ʽΪ��
Na2SO3(s)+H2SO4(75%)=Na2SO4+SO2��+H2O
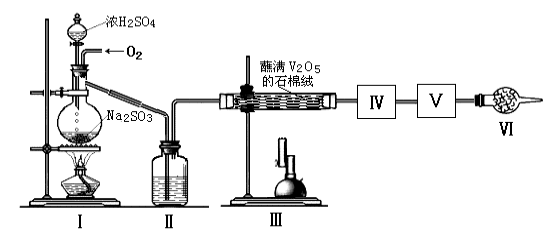
��1�����е��Լ��� ��������������Ϊ ��
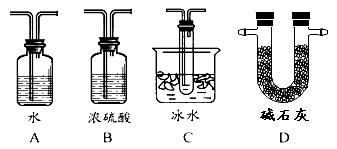
��2������ʵ����Ҫ��Ӧ���������������Ӻ��ʵ�װ�á������ͼA��Dװ����ѡ�����ʺ�װ�ò��������������Ŀո��У������������ӵ�װ�÷ֱ��� �� ��
��3��Ϊ�����SO2��ת���ʣ�ʵ��ʱ�ڣ��ٵμ�Ũ�����������ȴ����IJ����У�Ӧ��ȡ�IJ�������_______��_________(����)��
��4��ʵ�������������ռ�SO3���Թ�����¶���ڿ����У��ܹ������ܿ��д����İ����������������ԭ���� ��
��5����18.9gNa2SO3��ĩ��������Ũ��������д�ʵ�飬����Ӧ����ʱ������ͨ��O2һ��ʱ�����װ����������7.2g����ʵ����SO2��ת����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶Ⱥ�ѹǿ�£��ϳɰ���Ӧ�ﵽƽ��ʱ�����в�������ʹƽ�ⷢ���ƶ�����
A�����¡���ѹʱ���백�� B�����¡�����ʱ���뵪
C�����¡�����ʱ���뺤�� D�����¡���ѹʱ���뺤��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����98%��Ũ����(���ܶ�Ϊ1.84 g/cm3)����100 mL 1.0 mol��L��1ϡ����,��ʵ��������:
A��100mL��Ͳ
B��������ƽ
C��������
D��50mL����ƿ
E��10mL��Ͳ
F����ͷ�ι�
G��50mL�ձ�
H��100mL����ƿ
(1)����ȡŨ��������Ϊ mL��
(2)ʵ��ʱѡ�õ������� (����ĸ)
(3)���в����ᵼ��������ҺŨ��ƫ�͵���________(�����)
�����ձ��н�����Һʱ��������Һ�彦��
������ҡ�Ⱥ�����ҺҺ����ڿ̶��ߣ��ֵμ�����ˮ���̶���
������ƿʹ��ǰδ���и���
��û��ϴ���ܽ�ʱ���õ��ձ��Ͳ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ܱ��ݻ��������н��з�Ӧ��2SO2(g)+O2(g) ![]() 2SO3(g)����֪��Ӧ������ijһʱ��SO2��O2��SO3��Ũ�ȷֱ�Ϊ0.2 molL-1��0.1 molL-1��0.2 molL-1������Ӧ��ƽ��ʱ�����ܴ��ڵ������ǣ� ��
2SO3(g)����֪��Ӧ������ijһʱ��SO2��O2��SO3��Ũ�ȷֱ�Ϊ0.2 molL-1��0.1 molL-1��0.2 molL-1������Ӧ��ƽ��ʱ�����ܴ��ڵ������ǣ� ��
A. SO2Ϊ0.4 molL-1��O2Ϊ0.2 molL-1 B. SO2Ϊ0.25 molL-1
C. SO2��SO3��Ϊ0.15 molL-1 D. SO3Ϊ0.4 molL-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У���ȷ����( )
A������ı�ȼ����Ϊ890.3kJ��mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4(g)+ 2O2 (g)=CO2(g)+2H2O(g) ��H��-890.3 kJ��mol-1
B��500����30MPa�£���0.5 molN2��1.5molH2�����ܱյ������г�ַ�Ӧ����NH3(g)������193kJ�����Ȼ�ѧ����ʽΪ��N2+3H2![]() 2NH3(g) ��H��-38.6kJ��mol-1
2NH3(g) ��H��-38.6kJ��mol-1
C����ܵ���������ʹ��Ӧ�������Ի�ѧ��Ӧ�Ļ�ܲ����ܽӽ�����������
D�������£���ӦC(s)+ CO2 (g)=2CO(g)�����Է����У���÷�Ӧ����H>0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������VSEPRģ���жϣ�������������ԭ�Ӷ���ͬһƽ���ϵ�һ���� ��
A��SO32����NO2�� B��NO3����SO3
C��H3O+��ClO3�� D��PO43����SO32��
��CaF2�ľ�����ͼ��ʾ��
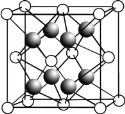
�������й�CaF2�ı�����ȷ����______________��
a��Ca2+��F��������ھ�����������
b��F�������Ӱ뾶С��Cl������CaF2���۵����CaCl2
c�����������ӱ�Ϊ2:1�����ӻ��������CaF2���幹����ͬ
d��CaF2�еĻ�ѧ��Ϊ���Ӽ������CaF2������״̬���ܵ���
��CaF2������ˮ���������ں�Al3+����Һ����ԭ����________________________ (�����ӷ���ʽ��ʾ����֪[AlF6]3������Һ�п��ȶ�����)��
��������F������λ����_________����һ��Ca2+�Ⱦ����������Ca2+��_______����
��ͭ��п����Ԫ�صĵ�һ�����ܡ��ڶ������������ʾ
������/kJ��mol��1 | I1 | I2 |
ͭ | 746 | 1958 |
п | 906 | 1733 |
��д��Cuԭ�Ӻ�������Ų�ʽ ��
��ͭ�ĵ�һ������(I1)С��п�ĵ�һ�����ܣ���ͭ�ĵڶ�������(I2)ȴ����п�ĵڶ������ܣ�����Ҫԭ���� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com