
A、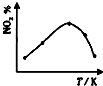 |
B、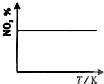 |
C、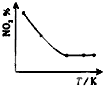 |
D、 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、Na+、Mg2+ |
| B、Fe2+、Cu2+ |
| C、Al3+、Cu2+ |
| D、Mg2+、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、1mol L分别与足量NaOH和H2反应,最多可消耗2mol NaOH和8mol H2 |
| B、有机酸M与油酸互为同系物,双酚A与苯酚互为同系物 |
| C、与M含相同官能团的同分异构体还有2种 |
| D、等物质的量的L、A和M 与足量浓溴水发生反应,消耗Br2的量之比为1:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子键没有方向性和饱和性,共价键有方向性和饱和性 |
| B、配位键在形成时,由成键双方各提供一个电子形成共用电子对 |
| C、金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用 |
| D、金属键中的“自由电子”为金属阳离子共用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H<0,△S>0的反应肯定是自发的 |
| B、△H<0,△S<0的反应肯定是自发的 |
| C、△H>0,△S>0的反应肯定是自发的 |
| D、△H>0,△S<0的反应肯定是自发的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6.02×1023个碳原子的质量为1g |
| B、钠原子的摩尔质量为23g |
| C、1molHCl的体积是22.4L |
| D、CO2的摩尔质量为44g?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
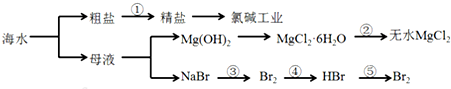
| A、从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能的过程 |
| B、过程②中结晶出的MgCl2?6H2O要在HCl氛围中加热脱水制得无水MgCl2 |
| C、经过③④实现了溴元素的富集 |
| D、电解MgCl2溶液制取Mg单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com