
Q、W、X、Y、Z为五种原子序数递增的短周期元素。
已知:①Q原子核外电子数等于电子层数,且与W组成的化合物是沼气的主要成分;
②W与Y、X与Y组成的化合物是机动车排出的大气污染物;
③Y与Z能形成电子总数为30和38的两种离子化合物。
(1)W在周期表的位置:________;电子数为38的Y与Z形成化合物的电子式:________。
(2)工业合成XQ3,ΔH<0;下列措施既能加快反应速率,又能使原料转化率一定都提高的是________。
A.升高温度 B.加入高效催化剂
C.将XQ3及时分离出去 D.增大反应体系压强
E.增大反应物浓度
(3)标准状况下22.4 L X的气态氢化物,与0.5 L 1 mol/L的X的最高价氧化物的水化物反应,所得碱性溶液中离子浓度由大到小顺序是_______(用化学式表示)。
【解析】 由①推知Q为H,沼气的主要成分是甲烷,故W为C;由②中W与Y形成的化合物是机动车排出的大气污染物可知,该化合物为CO,故Y为O,Q、W、X、Y原子序数递增,故X是N;Na2O含有30个电子,Na2O2含有38个电子,故Z为Na。(1)W是碳元素,为元素周期表中第6号元素,位于第二周期ⅣA族;Na2O2为离子化合物,且存在过氧键(—O—O—),因此其电子式为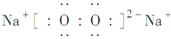 。(2)XO3为NH3,工业合成氨利用氢气与氮气反应,该反应为放热反应,升高温度可以提高反应速率,但会降低反应物的转化率,A项错;加入催化剂,可以提高反应速率,但不能提高反应物的转化率,B项错;将氨气及时分离出去可以提高原料的转化率,但同时也降低了反应速率,C项错;增大反应体系压强,体系中的物质浓度增大,反应速率增大,且该反应为气体分子数减小的反应,故也能提高反应物的转化率,D项正确;若增大一种反应物的浓度可以提高反应速率,但会降低该反应物的转化率,E项错。(3)氨气与硝酸反应的化学方程式为NH3+HNO3===NH4NO3。氨气的物质的量n(NH3)=22.4 L÷22.4 L/mol=1 mol,n(HNO3)=0.5 L×1 mol/L=0.5 mol。由此可知氨气过量0.5 mol,溶液中存在NH3·H2O的电离和NH
。(2)XO3为NH3,工业合成氨利用氢气与氮气反应,该反应为放热反应,升高温度可以提高反应速率,但会降低反应物的转化率,A项错;加入催化剂,可以提高反应速率,但不能提高反应物的转化率,B项错;将氨气及时分离出去可以提高原料的转化率,但同时也降低了反应速率,C项错;增大反应体系压强,体系中的物质浓度增大,反应速率增大,且该反应为气体分子数减小的反应,故也能提高反应物的转化率,D项正确;若增大一种反应物的浓度可以提高反应速率,但会降低该反应物的转化率,E项错。(3)氨气与硝酸反应的化学方程式为NH3+HNO3===NH4NO3。氨气的物质的量n(NH3)=22.4 L÷22.4 L/mol=1 mol,n(HNO3)=0.5 L×1 mol/L=0.5 mol。由此可知氨气过量0.5 mol,溶液中存在NH3·H2O的电离和NH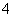 的水解,因最终溶液呈碱性,故离子浓度大小顺序为c(NH
的水解,因最终溶液呈碱性,故离子浓度大小顺序为c(NH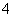 )>c(NO
)>c(NO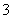 )>c(OH-)>c(H+)。
)>c(OH-)>c(H+)。
【答案】 (1)第二周期ⅣA族 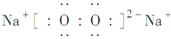
(2)D (3)c(NH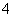 )>c(NO
)>c(NO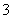 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)


科目:高中化学 来源: 题型:
如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是
A.X极是电源负极,Y极是电源正极
B.a极的电极反应是2Cl--2e-===Cl2↑
C.电解过程中CuSO4溶液的pH逐渐增大
D.Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体

查看答案和解析>>
科目:高中化学 来源: 题型:
碳酸钙常用作牙膏的摩擦剂。某同学设计了一种制备碳酸钙的方案,其流程图如下:(所用石灰石含有杂质SiO2)

回答下列问题:
(1)充分煅烧110吨石灰石得到固体66吨。标准状况下生成二氧化碳的体积为______________L,石灰石中碳酸钙的质量分数为______________%。
(2)假设第①步反应完全进行,则第②步反应过滤后得到的不溶性滤渣的成分为________________________。
(3)第③步反应一般不采用通入CO2的主要原因是______________________,
相应的离子方程式为_____________________________________。
(4)CaCO3是一种难溶物质,25℃时其Ksp=2.8×10-9。现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2.0×10-4 mol/L,则生成沉淀所需CaCl2溶液的物质的量浓度最小是______________。
(5)某学生用石灰石为原料,设计了另一种制备碳酸钙的实验方案,其流程图如下:
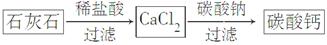
与前一方案相比较,该方案的优点是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
石灰氮(CaCN2)是一种绿色的农药和化肥,可用作除草剂、杀菌剂、杀虫剂和棉花脱叶剂,其可由CaC2(离子化合物)与N2反应制得。下列各项表达中不正确的是( )
A.C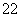 的电子式为
的电子式为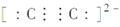
B.N2的结构式为N≡N
C.1 mol CN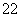 所含的电子总数为22 mol
所含的电子总数为22 mol
D.Ca2+的结构示意图为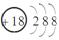
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g)
ΔH1=+49.0 kJ/mol;
②CH3OH(g)+ O2(g)===CO2(g)+2H2(g)
O2(g)===CO2(g)+2H2(g)
ΔH2=-192.9 kJ/mol。
根据上述反应,下列说法正确的是( )
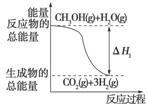
A.反应①中的能量变化如上图所示
B.CH3OH转变成H2的过程一定要吸收能量
C.1 mol CH3OH充分燃烧放出的热量为192.9 kJ
D.可推知2H2(g)+O2(g)===2H2O(g)
ΔH=-483.8 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com