
如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是
A.X极是电源负极,Y极是电源正极
B.a极的电极反应是2Cl--2e-===Cl2↑
C.电解过程中CuSO4溶液的pH逐渐增大
D.Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某研究性学习小组就Na2O2的有关性质探究如下:向滴有酚酞的水中投入一定量的 Na2O2,观察到先有大量气泡产生,溶液变红,过一会儿溶液又变为无色。
Na2O2,观察到先有大量气泡产生,溶液变红,过一会儿溶液又变为无色。
对上述实验中溶液变红,过一会儿又褪色的原因,甲、乙两同学提出了不同的解释:
甲同学认为是Na2O2与水反应放出氧气,氧气有氧化性,将酚酞氧化而使溶液褪色;
乙同学则认为是Na2O2与水反应时产生了H2O2,H2O2的强氧化性使酚酞褪色。
(1)乙同学设计了如下实验来证明自己的猜想是正确的:在滴有酚酞的氢氧化钠溶液中滴加3%的H2O2溶液并振荡。
①若乙同学的猜想正确,可观察到的现象是___________________________。
②甲同学针对乙同学的上述验证实验提出还应增做实验才能更直接证明 Na2O2与水反应生成了H2O2,甲同学提出要增加的实验是什么?
Na2O2与水反应生成了H2O2,甲同学提出要增加的实验是什么?
(2)试设计简单实验证明甲同学的解释是否正确(画出简易装置图,说明简要步骤)。
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应2NO2 2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2 的同时生成2n molNO ②单位时间内生成n mol O2 的同时生成2n molNO2 ③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
A.①④ B.②④ C.①③④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右图所示,电解总反应为:2Cu+H2O Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1 mol电子转移时,有0.1 mol Cu2O生成

查看答案和解析>>
科目:高中化学 来源: 题型:
向足量H2SO4溶液中加入100 mL 0.4 mol·L-1 Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入100 mL 0.4 mol·L-1盐酸时,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为
A.Ba2+(aq)+SO (aq)===BaSO4(s) ΔH=-2.92 kJ·mol-1
(aq)===BaSO4(s) ΔH=-2.92 kJ·mol-1
B.Ba2+(aq)+SO (aq)===BaSO4(s) ΔH=-18 kJ·mol-1
(aq)===BaSO4(s) ΔH=-18 kJ·mol-1
C.Ba2+(aq)+SO (aq)===BaSO4(s) ΔH=-73 kJ·mol-1
(aq)===BaSO4(s) ΔH=-73 kJ·mol-1
D.Ba2+(aq)+SO (aq)===BaSO4(s) ΔH=-0.72 kJ·mol-1
(aq)===BaSO4(s) ΔH=-0.72 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下

依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为 ,与电源负极相连的电极附近,溶液pH (选填“不变”“升高”或“下降”)。
(2)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是 (选填a,b,c多选扣分)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(3)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 (选填a、b、c多选扣分)。
a.先加NaOH,后加Na2CO3,再加钡试剂 b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(4)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为 ___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
五种元素在元素周期表中的相对位置如下表所示, 其中非金属元素X的单质是淡黄色晶体。下列判断不正确的是
 A.Z为Cl
A.Z为Cl
B.非金属性: X < T
C.原子半径:R <T<Q
D.最高价氧化物的水化物的酸性:T>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物A的相对分子质量为150。经李比希法测得其中含C 72.0%、H 6.67%,其余为氧。现代仪器分析有机化合物分子结构有以下两种方法:方法一:核磁共振仪可以测定A有五种化学环境不同的H原子,其个数比为1∶2∶2∶2∶3 。
方法二:利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如下图所示。
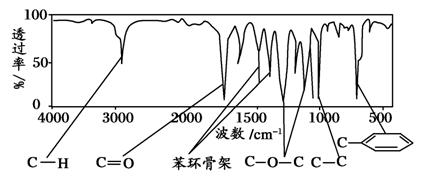
已知:A分子中只含一个苯环,且苯环上只有一个取代基,请回答:
(1)A的分子式为:_______________;
(2)A的结构简式为:_____________;
(3)推测A可能发生下列反应中的_________________;
a 加成 b 取代 c 氧化 d 加聚
(3)A的芳香类同分异构体有多种,请按相应要求写出一种结构简式:
①分子中含有苯环且不含甲基的羧酸:___________________________;
②苯环与羟基直接相连,且苯环上只有两个取代基的醛(含有-CHO):
______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
Q、W、X、Y、Z为五种原子序数递增的短周期元素。
已知:①Q原子核外电子数等于电子层数,且与W组成的化合物是沼气的主要成分;
②W与Y、X与Y组成的化合物是机动车排出的大气污染物;
③Y与Z能形成电子总数为30和38的两种离子化合物。
(1)W在周期表的位置:________;电子数为38的Y与Z形成化合物的电子式:________。
(2)工业合成XQ3,ΔH<0;下列措施既能加快反应速率,又能使原料转化率一定都提高的是________。
A.升高温度 B.加入高效催化剂
C.将XQ3及时分离出去 D.增大反应体系压强
E.增大反应物浓度
(3)标准状况下22.4 L X的气态氢化物,与0.5 L 1 mol/L的X的最高价氧化物的水化物反应,所得碱性溶液中离子浓度由大到小顺序是_______(用化学式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com