
����Ŀ�����ݱ�����Ϣ���ж�������������ȷ����(��)
��� | ������ | ��ԭ�� | ������Ӧ�� | �������� | ��ԭ���� |
�� | Cl2 | FeBr2 | / | Fe3����Br2 | |
�� | KClO3 | Ũ���� | / | Cl2 | |
�� | KMnO4 | H2O2 | H2SO4 | O2 | Mn2�� |
A. �ɱ����������Ϣ��֪ͨ��Cl2������ͬ������������ܲ�ͬ
B. ��Ӧ���У���ֻ������Cl2ʱ����Ӧ�ɱ�ʾΪCl2�� Fe2��===Fe3���� 2Cl��
C. �������鷴Ӧ�Ļ�ԭ������KCl������ת����Ŀ��6e��
D. �������鷴Ӧ�����ӷ���ʽΪ2MnO![]() �� 3H2O2��6H��===2Mn2���� 4O2���� 6H2O
�� 3H2O2��6H��===2Mn2���� 4O2���� 6H2O

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ������í�����ڱ�¶�ڳ�ʪ�Ŀ����У��γ�һ������ˮĤ����í���ᱻ��ʴ��ʾ��ͼ���¡�����˵������ȷ����

A. ��ʴ������ͭ����ʼ��ֻ������ 2H++2e-= H2��
B. ��ˮĤ������ʳ�ν��ӿ���í���ĸ�ʴ
C. ���ڽ�������Ϳһ����֬�ܷ�ֹ��í������ʴ
D. ������ͭ����ֱ����������������ͭ���ѱ���ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Է�������Ϊ 43 �����ȡ���ױ��ϵ�һ����ԭ�ӣ����÷������������ĿΪ�� ��
A.3 ��B.4 ��C.6 ��D.8 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ���CO��H2�ϳɼ״�����Ӧ����ʽΪ��
CO (g) +2H2 (g) ![]() CH3OH (g) ��H����T1��ʱ�����Ϊ2L�ĺ��������г������ʵ���֮��Ϊ3mol��H2��CO���ﵽƽ��ʱCH3OH���������(V%)��n(H2)��n(CO)�Ĺ�ϵ��ͼ1��ʾ��
CH3OH (g) ��H����T1��ʱ�����Ϊ2L�ĺ��������г������ʵ���֮��Ϊ3mol��H2��CO���ﵽƽ��ʱCH3OH���������(V%)��n(H2)��n(CO)�Ĺ�ϵ��ͼ1��ʾ��

(1)����ʼn (H2)��n(CO) =2������5min�ﵽƽ�⣬��ʱ������ѹǿ�dz�ʼѹǿ��0.7������0��5min��ƽ����Ӧ����v(H2)=____������ʱ���������м���0.15 mol CO (g)��0.05 mol CH3OH (g)������ƽ��ʱH2��ת���ʽ�_______��ѡ���������С�����䡱����
(2)����ʼn (H2)��n(CO) =3.5ʱ���ﵽƽ��״̬��CH3OH���������������ͼ���е�_____�㣨ѡ�D������E����F������
(3)��ͼ2��֪�÷�Ӧ�ġ�H_____0��ѡ�>������<����=������ͬ����ѹǿpl____p2����ѹǿΪp2ʱ����y�㣺v������____v���棩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й���ͼ��ʾ�������˵������ȷ����( )��

A. �ȿ�����Br2��CCl4��Һ�����ӳɷ�Ӧ���ֿ�����Br2����ȡ����Ӧ
B. 1mol�û�������������3molNaOH��Ӧ
C. �ȿ��Դ����⣬�ֿ���ʹ����KMnO4��Һ��ɫ
D. �ȿ�����FeCl3��Һ������ɫ��Ӧ���ֿ�����NaHCO3��Һ��Ӧ�ų�CO2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���ϣ�Χ����Ļ��������ʽ�������̽���������Ҫ��ش��������⣮ 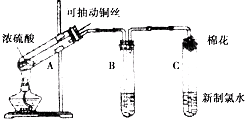
��1��װ��A�з�Ӧ�Ļ�ѧ����ʽΪ ��
��2��װ��B����̽��SO2��Ư���ԣ���Ӧװ���Լ��� �� ��Ӧһ��ʱ�������������������Cl2ͨ��B��Ҳ�ܿ���ͬ��������������ڷ�Ӧԭ���������ͬ������ͬ������
��3��װ��C����SO2�����ԣ����������ԭ������װ��C�Թܿ�����Ӧպ����Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1.52g ͭþ�Ͻ���ȫ�ܽ���50mL �ܶ�Ϊ1.40 g/mL����������Ϊ63%��Ũ�����У��õ�NO2��N2O4�Ļ������1120 mL����״��������Ӧ�����Һ�м���1.0 mol/L NaOH��Һ������������ȫ������ʱ���õ�2.54 g����������˵������ȷ���ǣ�������
A. �úϽ���ͭ��þ�����ʵ���֮����2:1
B. ��Ũ������HNO3�����ʵ���Ũ����14.0 mol/L
C. NO2��N2O4�Ļ�������У�NO2�����������80%
D. �õ�2.54 g����ʱ������NaOH��Һ�������600 mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȼ�ϵ�أ�SOFC���Թ�����������Ϊ����ʣ��乤��ԭ����ͼ��ʾ�����й��ڹ���ȼ�ϵ�ص��й�˵������ȷ���ǣ�������

A. ������������������õ����ڵ����ͨ��
B. ������������O2����a����b���ƶ�
C. �缫bΪ��صĸ������缫��ӦʽΪ��O2+4e��=2O2��
D. ����C3H8Ϊȼ��������Ӵ����Ϸ����ķ�ӦΪC3H8��20e��+10O2���T3CO2+4H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�0.1 mol��L��1��ij��Ԫ��H2A��Һ�У����ܴ��ڵĺ�A����(H2A��HA����A2��)�����ʵ���������pH�仯�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����(����)

A. H2A�ĵ��뷽��ʽ��H2A![]() H����HA��
H����HA��
B. pH��5ʱ,��NaHA��Na2A�Ļ����Һ��:c(HA��):c(A2��)��1:100
C. �����ʵ���Ũ�ȵ�NaHA��Na2A��Һ�������ϣ� ����Ũ�ȴ�С��ϵΪ��c(Na��)>c(HA��)>c(A2��)
D. Na2A��Һ�ش���c(OH��)��c(H��)��c(HA��)�� 2c(H2A)��������Ũ�Ⱦ�����0
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com