
【题目】我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应H2S+O2==H2O2+S。已知甲池中发生的反应为


下列说法不正确的是
A. 该装置中存在光能向电能的转化
B. H+从乙池移向甲池
C. 乙池溶液中发生的反应为H2S+I3-===3I-+S+2H+
D. 甲池中炭棒上发生的电极反应为AQ+2H+-2e-===H2AQ
科目:高中化学 来源: 题型:
【题目】对于反应2X(g) + Y(g) ![]() 3Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
3Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
(1)升高温度:____________;
(2)增大压强:____________;
(3)增大容器容积:______________;
(4)加入 X :______________;
(5)加入 Y :______________;
(6)压缩体积:______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe@Fe2O3纳米线是一种新型铁基材料,在催化、生物医药、环境科学等领域具有广阔应用前景。某研究小组以赤泥(铝土矿提取氧化铝过程中产生的固体废弃物,含SiO2、Fe2O3、Al2O3)为原料,设计下列流程制备Fe@Fe2O3纳米线并探究其在水处理中的应用。
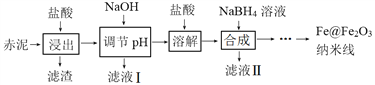
回答下列问题:
(1)“浸出”实验中,盐酸起始浓度对铁、铝浸出率的影响如图所示:
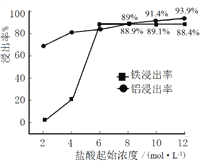
①盐酸的合适浓度为______________。
②盐酸起始浓度为2 mol·L﹣1时,铁的浸出率很低,原因是______________。
(2)已知:25℃时,Al(OH)3(s)![]() AlO2-+ H+ + H2O K=4×10-13。若浸出液c(Al3+) = 0.04 mol·L-1,“调节pH”时,pH最小应为______________(设调节pH过程中溶液体积不变)。
AlO2-+ H+ + H2O K=4×10-13。若浸出液c(Al3+) = 0.04 mol·L-1,“调节pH”时,pH最小应为______________(设调节pH过程中溶液体积不变)。
(3)Fe@Fe2O3纳米线为壳层结构(核是Fe、壳是Fe2O3),壳是由中心铁核在合成过程中被氧化而形成。
①“合成”时滴加NaBH4溶液过程中伴有气泡产生,滤液Ⅱ中含B(OH)3,合成铁核的离子方程式为____________________________。
②“合成”后,经过滤、______________、______________获得Fe@Fe2O3纳米线。
(4)Fe@Fe2O3纳米线去除水体中Cr2O72-的机理是,纳米线将Cr2O72-吸附在表面并还原。在“无氧”和“有氧”条件下将纳米线分别置于两份相同的水体中,80 min后回收该纳米线,测得其表面元素的原子个数比如下表:

①在水体中Fe@Fe2O3纳米线形成的分散系是____________________________。
②样本2的实验条件是______________(填“有氧”或“无氧”)。
③已知水体中检测不到Cr(Ⅲ),样本1中Fe@Fe2O3纳米线的表面Cr(Ⅵ)的去除率为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构可用“键线式”表示,如CH3—CH=CH—CH3可简写为![]() ,有机物X的键线式为
,有机物X的键线式为![]() 。下列关于有机物X的说法中正确的是
。下列关于有机物X的说法中正确的是
A. X的含氧官能团是羧基和醚键
B. X的分子式为C7H7O3
C. X因能与酸性KMnO4溶液发生取代反应而褪色
D. 有机物Y是X的同分异构体,能与碳酸氢钠溶液反应且含苯环,则Y的结构有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.6 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.15mol·L-1·s-1
③2s时物质A的转化率为30%
④2s时物质B的浓度为0.3 mol·L-1
其中正确的是
A. ①③ B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。
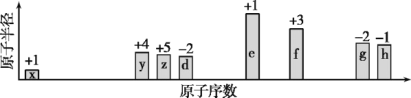
根据判断出的元素回答问题:
(1)h在周期表中的位置是_______。
(2)比较d、f离子半径大小(用化学式表示,下同):_>_。g、h的最高价氧化物对应水化物的酸性强弱:__ >__。
(3)h的单质与e的最高价氧化物对应水化物反应的离子方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种药物合成的中间体,其结构简式如图所示。下列有关化合物X的说法正确的是

A. 化合物X的分子式为C16H16O6
B. 能发生加成反应、取代反应、消去反应
C. 可与FeCl3溶液发生显色反应,但不能发生氧化反应
D. 1mol化合物X最多可与5molNaOH、7mol H2、4molBr2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,作为信息产业和机电工业的重要基础功能材料,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上以软锰矿(主要成分为MnO2)和黄铁矿(主要成分为FeS2)为主要原料制备碳酸锰的主要工艺流程如下:

已知:几种金属离子沉淀的pH如下表。
Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
完全沉淀的pH | 9.2 | 3.7 | 7.8 | 10. 4 |
回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,采取的措施不合理的有________。
A.搅拌 B.适当升高温度 C.研磨矿石 D.加入足量的蒸馏水
(2)溶浸过程中主要产生的金属阳离子为Fe3+、Mn2+,浸取后的溶液中含有少量Fe2+、Cu2+、Ca2+,则在加入石灰调节溶液的pH从而使铁元素被完全沉淀前,加入适量的软锰矿,其发生反应的离子方程式为____________________,加入石灰调节溶液pH的范围为____________________。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质,故滤渣主要是________(填化学式)和CaF2。若测得滤液中c(F-)为0.01mol·L-1,则滤液中残留c(Ca2+)为________mol·L-1[已知:Ksp(CaF2)=1.46×10-10]。
(4)有人认为净化工序中使用NaF会引起污染,建议用(NH4)2CO3代替NaF,但是用(NH4)2CO3代替NaF的缺点是______________________________________。
(5)下图为黄铁矿的质量分数对锰浸出率的影响,仅据图中信息,黄铁矿的质量分数应保持在________%左右。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com