
【题目】在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
C(N2O4) | 0. 20 | a | 0.10 | c | d | e |
C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)该反应的化学方程式为__________________________,表中b_________c(填“<”、“=”、“>”)。
(2)20s时,N2O4的的浓度为__________________mol·L-1,0~20s内N2O4的平均反应速率为________________;
(3)该反应的平衡常数表达式K=___________________
在80℃时该反应的平衡常数K值为:______________(保留到小数点后2位)。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时____________。
A.N2O4的转化率越高 B.NO2的产量越大
C.N2O4与NO2的浓度之比越大 D.正反应进行的程度越大
【答案】(每空2分,共12分)(1)N2O4![]() 2NO2,吸热
2NO2,吸热
(2)0.14, 0.003 mol/(L·s) (3)0.54 (4)ABD
【解析】试题分析:(1)N2O4分解生成NO2,反应的化学方程式是N2O4![]() 2NO2。根据表中数据可知,反应进行到60s时,物质到浓度不再发生变化,说明反应达到平衡状态。当反应进行到反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅,这说明降低温度反应写逆反应方向移动,因此正反应是吸热反应。
2NO2。根据表中数据可知,反应进行到60s时,物质到浓度不再发生变化,说明反应达到平衡状态。当反应进行到反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅,这说明降低温度反应写逆反应方向移动,因此正反应是吸热反应。
(2)20s时,四氧化二氮的浓度为a
N2O4 ![]() 2NO2
2NO2
1mol/L 2mol/L
(0.20-a)mol/L 0.12mol/L
解得a=0.14mol/L
则反应的N2O4浓度为(0.2-0.14)mol/L=0.06mol/L
则反应速率v(N2O4)=0.06mol/L÷20s=0.003 mol/(L·s)
(3)平衡时NO2当浓度是0.22mol/L,则N2O4的浓度是0.2mol/L-0.11mol/L=0.09mol/L
所以根据反应的方程式可知,平衡常数K=![]()
(4)根据化学平衡常数知,K越大,生成物的浓度越大,反应物的浓度越小,N2O4的转化率大、NO2的产量越大、N2O4与NO2的浓度之比越小、正反应进行的程度越大,即选项ABD正确,答案选ABD。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡: CO(g)+H2S(g)![]() COS(g)+H2(g) ,K=0.1,反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
COS(g)+H2(g) ,K=0.1,反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
A. 升高温度,H2S浓度增加,表明该反应的△H>0
B. 随着反应的进行,混合气体的密度逐渐减小
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.电解质溶液在通电时才可以电离
B.金属氧化物一定都是碱性氧化物
C.非金属氧化物都是酸性氧化物
D.碱性氧化物一定都是金属氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“2015·8·12”天津港爆炸中有一定量的氰化物泄露。氰化物多数易溶于水,有剧毒,易造成水污染。已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
(1)根据价键规则,写出H2CO3的结构式__________。
(2)下列能用于判断氮、碳两种元素非金属性强弱的是_________(填序号)
a. 气态氢化物的稳定性强弱 b. 最高价氧化物对应水化物酸性强弱
c. Al2O3+N2+3C=2AlN+3CO d. 比较在周期表中的位置
(3)0.01mol/L的NaCN溶液pH=9,用离子方程式表示呈碱性的原因_______。 请判断该溶液中:c(CN-)__c(OH-)(填“>”、“<”或“=”)
(4)含CN-的污水危害很大,处理该污水时,可在催化剂TiO2作用下用NaClO将CN-氧化成CNO-。CNO-在酸性条件下继续被NaClO氧化生成N2与CO2。某环保部门用下图装置进行实验,以证明该处理方法的有效性并测定CN-被处理的百分率。

将浓缩后含CN-的废水与过量NaClO溶液的混合液(其中CN-浓度为0.05mol/L)200mL倒入甲中,塞上橡皮塞,一段时间后,打开活塞,使溶液全部放入乙中,关闭活塞。
①甲中反应的离子方程式为___________,乙中反应的离子方程式为________。
②上述实验是通过测定CO2的量来确定CN-的处理效果。若丙中的试剂是饱和食盐水,且丙、丁都是除杂装置,则乙中产生的气体除CO2、N2外,还可能含有的杂质气体是__________,戊中盛有足量的石灰水,若实验后戊中生成0.9g沉淀,则CN-被处理的百分率为_________。
(5)装置中碱石灰的作用是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因
A. 电子由激发态向基态跃迁时以光的形式释放能量
B. 电子由基态向激发态跃迁时吸收除红光以外的光线
C. 氖原子获得电子后转变成发出红光的物质
D. 在电流的作用下,氖原子与构成灯管的物质发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生活密切相关。对下列现象或事实的解释不正确的是
选项 | 现象或事实 | 解释或对应的离子方程式 |
A | 用热的纯碱溶液洗去油污 | CO32-+H2O 溶液呈碱性,温度升高碱性增强 |
B | 酸雨样品在空气中放置pH减小 | 亚硫酸被氧化为硫酸 2H2SO3+O2=2H2SO4 |
C | “84”消毒液具有漂白性 | ClO-+CO2+H2O=HClO+HCO3- |
D | 用加热法除去NaCl固体中混有的NH4Cl固体 | NH4Cl固体可以完全分解成为气体而除去 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对四组无色透明溶液进行离子检验,四位同学各鉴定一组,他们的实验报告的结论如下,其中可能正确的是
A. MnO4—、K+、S2—、Na+ B. Mg2+、NO3—、OH—、Cl—
C. K+、H+、Cl—、CO32— D. Na+、OH—、Cl—、NO3—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
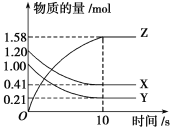
(1)从反应开始到10 s时,用Z表示的反应速率为_____________________________。
(2)该反应的化学方程式为__________________________________________________。
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的反应速率之比等于化学计量数之比
(1)一定能证明2SO2(g)+O2(g)![]() 2SO3(g)达到平衡状态的是_______(填序号,下同)。
2SO3(g)达到平衡状态的是_______(填序号,下同)。
(2)一定能证明I2(g)+H2(g)![]() 2HI(g)达到平衡状态的是 ____________。
2HI(g)达到平衡状态的是 ____________。
(3)一定能证明A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是_________。
C(g)+D(g)达到平衡状态的是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com