
【题目】(15分)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeOCr2O3 , 还含有硅、铝等杂质.制备流程如图所示: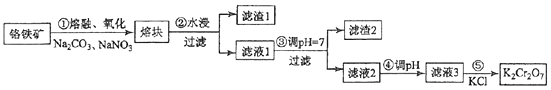
回答下列问题:
(1)步骤①的主要反应为:FeOCr2O3+Na2CO3+NaNO3 ![]() Na2CrO4+Fe2O3+CO2+NaNO2上述反应配平后FeOCr2O3与NaNO3的系数比为 . 该步骤不能使用陶瓷容器,原因是 .
Na2CrO4+Fe2O3+CO2+NaNO2上述反应配平后FeOCr2O3与NaNO3的系数比为 . 该步骤不能使用陶瓷容器,原因是 .
(2)滤渣1中含量最多的金属元素是 , 滤渣2的主要成分是及含硅杂质.
(3)步骤④调滤液2的pH使之变(填“大”或“小”),原因是(用离子方程式表示).
(4)有关物质的溶解度如图所示.
向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体.冷却到(填标号)得到的K2Cr2O7固体产品最多.
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是 .
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7 , 最终得到产品 m2 kg,产率为 .
【答案】
(1)2:7;二氧化硅与碳酸钠高温下反应生成硅酸钠和二氧化碳
(2)Fe;Al(OH)3
(3)小;CrO42﹣+2H+?Cr2O72﹣+H2O
(4)c;复分解反应
(5)![]()
×100%
【解析】解:(1)由上述分析可知步骤①的主要反应为2FeOCr2O3+4Na2CO3+7NaNO3 ![]() 4Na2CrO4+Fe2O3+4CO2+7NaNO2 , 则FeOCr2O3与NaNO3的系数比为2:7,该步骤不能使用陶瓷容器,原因是二氧化硅与碳酸钠高温下反应生成硅酸钠和二氧化碳,
4Na2CrO4+Fe2O3+4CO2+7NaNO2 , 则FeOCr2O3与NaNO3的系数比为2:7,该步骤不能使用陶瓷容器,原因是二氧化硅与碳酸钠高温下反应生成硅酸钠和二氧化碳,
故答案为:2:7;二氧化硅与碳酸钠高温下反应生成硅酸钠和二氧化碳;(2)由上述分析可知,滤渣1含Fe2O3 , 滤渣1中含量最多的金属元素是Fe,滤渣2的主要成分是Al(OH)3及含硅杂质,
故答案为:Fe;Al(OH)3;(3)④中调节pH发生CrO42﹣+2H+Cr2O72﹣+H2O,则步骤④调滤液2的pH使之变小,增大氢离子浓度,平衡正向移动,利于生成Cr2O72﹣ ,
故答案为:小;CrO42﹣+2H+Cr2O72﹣+H2O;(4)向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体,由溶解度可知,冷却到40℃K2Cr2O7固体的溶解度在四种物质中最小、且溶解度较大,过滤分离产品最多;步骤⑤发生Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,反应类型是复分解反应,
故答案为:c;复分解反应;(5)用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7 , 最终得到产品 m2 kg,产率为 ![]() ,由Cr原子守恒可知,则产率为
,由Cr原子守恒可知,则产率为 ![]() ×100%,
×100%,
故答案为: ![]() ×100%.
×100%.
铬铁矿的主要成分为FeOCr2O3 , 还含有硅、铝等杂质,制备重铬酸钾,由制备流程可知,步骤①的主要反应为FeOCr2O3+Na2CO3+NaNO3 ![]() Na2CrO4+Fe2O3+CO2+NaNO2 , Cr元素的化合价由+3价升高为+6价,Fe元素的化合价由+2价升高为+3价,N元素的化合价由+5价降低为+3价,由电子、原子守恒可知,反应为2FeOCr2O3+4Na2CO3+7NaNO3
Na2CrO4+Fe2O3+CO2+NaNO2 , Cr元素的化合价由+3价升高为+6价,Fe元素的化合价由+2价升高为+3价,N元素的化合价由+5价降低为+3价,由电子、原子守恒可知,反应为2FeOCr2O3+4Na2CO3+7NaNO3 ![]() 4Na2CrO4+Fe2O3+4CO2+7NaNO2 , 该步骤中若使用陶瓷,二氧化硅与碳酸钠高温下反应生成硅酸钠和二氧化碳,则使用铁坩埚,熔块水浸过滤分离出滤渣1含Fe2O3 , 滤液1中含NaAlO2、Na2CrO4 , 调节pH过滤分离出Al(OH)3、Si,滤液2中含Na2CrO4 , ④中调节pH发生CrO42﹣+2H+Cr2O72﹣+H2O,滤液3含Na2Cr2O7 , 由水中的溶解度:Na2Cr2O7>K2Cr2O7 , 可知⑤中向Na2Cr2O7溶液中加入KCl固体后得到K2Cr2O7 , 溶解度小的析出,以此来解答.
4Na2CrO4+Fe2O3+4CO2+7NaNO2 , 该步骤中若使用陶瓷,二氧化硅与碳酸钠高温下反应生成硅酸钠和二氧化碳,则使用铁坩埚,熔块水浸过滤分离出滤渣1含Fe2O3 , 滤液1中含NaAlO2、Na2CrO4 , 调节pH过滤分离出Al(OH)3、Si,滤液2中含Na2CrO4 , ④中调节pH发生CrO42﹣+2H+Cr2O72﹣+H2O,滤液3含Na2Cr2O7 , 由水中的溶解度:Na2Cr2O7>K2Cr2O7 , 可知⑤中向Na2Cr2O7溶液中加入KCl固体后得到K2Cr2O7 , 溶解度小的析出,以此来解答.


科目:高中化学 来源: 题型:
【题目】聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材枓的生物相容性方面有很好的应用前景。 PPG的一种合成路线如下: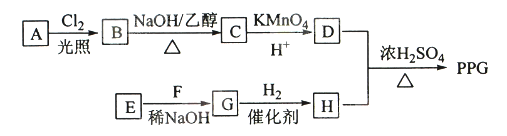
已知:
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;
②化合物B为单氯代烃:化合物C的分子式为C5H8;
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质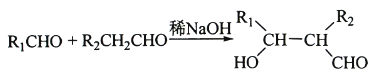
④
回答下列问题:
(1)A的结构简式为 。
(2)由B生成C的化学方程式为 。
(3)由E和F生成G的反应类型为 ,G的化学名称为 。
(4)①由D和H生成PPG的化学方程式为
②若PPG平均相对分子质量为10000,则其平均聚合度约为 (填标号)。
a.48 b.58 c.76 d.122
(5)D的同分异构体中能同时满足下列条件的共有 种(不含立体异构):
①能与饱和NaHCO3溶液反应产生气体 ②既能发生银镜反应,又能发生皂化反应
其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是 (写结构简式):
D的所有同分异构体在下列—种表征仪器中显示的信号(或数据)完全相同,该仪器是 (填标号)。
a.质谱仪 b.红外光谱仪c.元素分析仪d.核磁共振仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅单质及其化合物的说法正确的是( )
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③高纯度的硅单质广泛用于制作光导纤维
④陶瓷是人类应用很早的硅酸盐材料
A.①②
B.②③
C.①④
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下物质间的每步转化通过一步反应就能实现的是( )
A.Al﹣Al2O3﹣Al(OH)3﹣NaAlO2
B.S﹣SO3﹣H2SO4﹣MgSO4
C.Mg﹣MgCl2﹣Mg(OH)2﹣MgO
D.Si﹣SiO2﹣H2SiO3﹣Na2 SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种物质之间有如图所示的转化关系.已知:A是空气中的主要成分,B、C、D均为化合物,且C为红棕色气体,D为一种强酸. 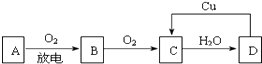
请回答下列问题:
(1)写出A和C的化学式:A , C;
(2)在上图D→C的过程中,D表现出强(填“氧化性”或“还原性”);
(3)在D的稀溶液中滴入NaOH溶液,其反应的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的性质与应用不正确的是
A. 液氯可以储存在钢瓶中
B. 二氧化硫可用于漂白纸浆
C. 碳酸钠是焙制糕点所用的发酵粉的主要成分之一
D. 硅晶体是半导体材料,广泛应用于电子工业的各个领域
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生如下反应:mA(g)+nB(g)pC(g)达到平衡后,保持温度不变,将容器体积缩小到原来的 ![]() ,当达到新平衡时,C的浓度为原来的1.9倍.下列说法中正确的是( )
,当达到新平衡时,C的浓度为原来的1.9倍.下列说法中正确的是( )
A.m+n>p
B.A的转化率降低
C.平衡向正反应方向移动
D.C的体积分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一些中学常见的物质之间的转化关系(其中部分反应产物省略),其中A和B常温下都是气体,且水溶液都有漂白性; F、M、N均为难溶于水的白色沉淀,其中M和N不溶于稀硝酸;C和D是两种常见的强酸.请回答下列问题: 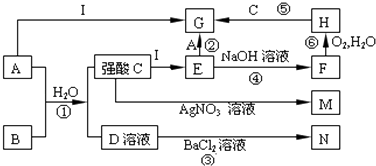
(1)写①的化学方程式
(2)写反应②的离子方程式 ﹣
(3)写出将A通入石灰乳的化学方程式
(4)在①②③④⑤⑥中,属于氧化还原反应的有:(填编号)
(5)F很不稳定,露置在空气中容易被氧化为H,该反应的化学方程式为 保存 E溶液时应加入少量的
(6)检验G溶液中阳离子的方法:(写出加入试剂的化学式和现象)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)水泥是重要的建筑材料.水泥熟料的主要成分为CaO、SiO2 , 并含有一定量的铁、铝和镁等金属的氧化物.实验室测定水泥样品中钙含量的过程如图所示: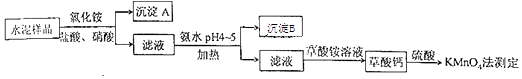
回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸.加入硝酸的目的是 , 还可使用代替硝酸.
(2)沉淀A的主要成分是 , 其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为 .
(3)加氨水过程中加热的目的是 . 沉淀B的主要成分为、(填化学式).
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:MnO4﹣+H++H2C2O4→Mn2++CO2+H2O.实验中称取0.400g水泥样品,滴定时消耗了0.0500molL﹣1的KMnO4溶液36.00mL,则该水泥样品中钙的质量分数为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com