
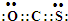 ,故答案为:
,故答案为: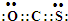 .
.


科目:高中化学 来源: 题型:
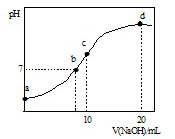 常温下,向20.00mL 0.1000mol?L-1 (NH4)2SO4溶液中逐滴加入0.2000mol?L-1 NaOH时,溶液的pH与所加NaOH溶液体积的关系如右图所示(不考虑挥发).下列说法正确的是 ( )
常温下,向20.00mL 0.1000mol?L-1 (NH4)2SO4溶液中逐滴加入0.2000mol?L-1 NaOH时,溶液的pH与所加NaOH溶液体积的关系如右图所示(不考虑挥发).下列说法正确的是 ( )| A、点a所示溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+) |
| B、点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) |
| C、点c所示溶液中:c(SO42-)+c(H+)=c(NH3?H2O )+c(OH-) |
| D、点d所示溶液中:c(SO42-)>c(NH3?H2O )>c(OH-)>c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | t |
查看答案和解析>>
科目:高中化学 来源: 题型:
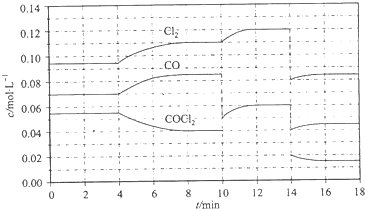 光气 (COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.
光气 (COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
| A、在冰醋酸中硫酸的电离方程式为H2SO4→2H++SO42- |
| B、在冰醋酸中高氯酸是这四种酸中最强的酸 |
| C、在冰醋酸中这四种酸都没有完全电离 |
| D、电解质的强弱与所处的溶剂相关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CO2+3H2
| |||
B、6CO2+6H2O
| |||
C、CO2+CH4
| |||
D、2CO2+6H2
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com