
下列说法正确的是
A.用乙醇或CCl4可提取碘水中的碘单质
B.NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同
C.24Mg32S晶体中电子总数与中子总数之比为1∶1
D.H2S和SiF4分子中各原子最外层都满足8电子结构
科目:高中化学 来源: 题型:
工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+ 12HF+ 3Na2CO3=2Na3AlF6+ 3CO2↑+ 9H2O
根据题意完成下列填空:
(1)在上述反应的反应物和生成物中,属于非极性分子的电子式 ,
属于弱酸的电离方程式 。
(2)反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是
(选填编号)。
a.气态氢化物的稳定性 b.最高价氧化物对应水化物的酸性
c.单质与氢气反应的难易 d.单质与同浓度酸发生反应的快慢
(3)反应物中某些元素处于同一周期。它们最高价氧化物对应的水化物之间发生反应的离子方程式为 。
(4) Na2CO3俗称纯碱,属于 晶体。工业上制取纯碱的原料是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素W、X、Y、Z 的原子序数依次增大,W与Y、X与Z 位于同一主族。W 与X 可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5 倍。下列叙述中不正确的是
A.WZ2分子中所有原子最外层都为8 电子结构
B.WX2、ZX2的化学键类型和晶体类型都相同
C.WX2是以极性键结合成的非极性分子
D.原子半径大小顺序为X <W<Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于粒子结构的描述不正确的是
A.H2S和NH3均是价电子总数为8的极性分子
B.HS-和HCl均是含有一个极性键的18电子粒子
C.CH2Cl2和CCl4均是四面体构型的非极性分子
D.1 mol D216O中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
请完成下列各题:
(1)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有________种。
(2)第ⅢA、ⅤA族元素组成的 化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为______________。在GaN晶体中,每个Ga原子与__________个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为________。在四大晶体类型中,GaN属于_______晶体。
化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为______________。在GaN晶体中,每个Ga原子与__________个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为________。在四大晶体类型中,GaN属于_______晶体。
(3)在极性分子NCl3中,N原子的化合价为-3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是_________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质性质的变化规律,与共价键的键能大小有关的是
A.F2、Cl2、Br2、I2的熔点、沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的熔点依次降低
查看答案和解析>>
科目:高中化学 来源: 题型:
关于同一种元素的原子或离子,下列叙述正确的是
A.原子半径比阴离子半径小
B.原子半径比阴离子半径大
C.原子半径比阳离子半径小
D.带正电荷多的阳离子半径比带正电荷少的阳离子半径大
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上利用某工厂的废渣(主要含CuO70%、MgFe2O420%,还含有少量FeO、NiO等氧化物)制取精铜和颜料铁红。流程如图所示。
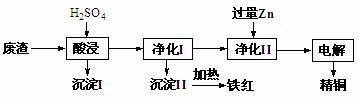
回答下列问题:
(1)净化Ⅰ操作分为两步:
第一步是将溶液中少量的Fe2+氧化;
第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下用H2O2氧化Fe2+反应的离子方程式: 。
②25 ℃时,pH=3的溶液中,c(Fe3+)=___________mol·L-1(已知25 ℃,Ksp[Fe( OH)3]=4.0×10-38)。
③净化Ⅰ中第二步可选用CuO实现转化,用化学平衡移动原理说明其原因:
。
(2)用净化II所得的金属为电极进行电解得精铜,请写出阴极所发生的电极反应式:______________________________。
(3)为准确测定酸浸液中Fe2+的物质的量浓度以确定H2O2的用量,测定步骤如下:
①取出25.00mL酸浸液,配制成250.0mL溶液。
②滴定:准确量取25.00mL所配溶液于锥形瓶中,将0.2000mol/LKMnO4溶液装入
(填仪器名称),进行滴定,记录数据,重复滴定3次,平均消耗KMnO4溶液V mL。(反应离子方程式:5Fe2++MnO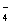 +10H+=5Fe3++Mn2++5H2O)
+10H+=5Fe3++Mn2++5H2O)
③计算酸浸液中Fe2+的物质的量浓度= mol/L (只列出算式,不做运算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水的离子反应是4FeO42-+10H2O===4Fe(OH)3(胶体)+3O2↑+8OH-,工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备:2Fe(OH)3+3ClO-+4OH-===2FeO42-+3Cl-+5H2O;
干法制备:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑。
下列有关说法中错误的是
A.高铁酸钾与水反应时,水发生氧化反应
B.干法中每生成1 mol Na2FeO4共转移4 mol电子
C.湿法中每生成1 mol Na2FeO4共转移3 mol电子
D.K2FeO4处理水时,不仅能杀菌,并使悬浮杂质沉降
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com