
I2在KI溶液中存在平衡: 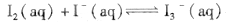 ,某I2、、KI混合溶液中, c(
,某I2、、KI混合溶液中, c( )与温度T的平衡曲线图如下。下列说法不正确的是
)与温度T的平衡曲线图如下。下列说法不正确的是

A. 反应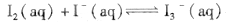 的△H>0
的△H>0
B.若温度为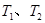 ,反应的平衡常数分别为
,反应的平衡常数分别为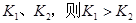
C.若反应进行到状态D时,一定有
D.状态A与状态B相比,状态A的c(I2) 小
A
【解析】
试题分析:A、由图象曲线的变化趋势可知,当温度升高时,I3-的物质的量浓度减小,说明该反应的正反应为放热反应,反应I2(aq)+I-(aq) I3-(aq)的△H<0,故A正确;B、该反应的正反应为放热反应,升高温度,平衡向逆反应方向移动,温度越高,平衡常数越小,若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2,故B正确;C、若反应进行到状态D时,反应未达到平衡状态,若反应趋向于平衡,则反应向生成的I3-方向移动,则v正>v逆,故C正确;D、状态A与状态B相比,B状态相当于在A的基础上升高温度,平衡向逆反应方向移动,则状态B的c(I2)大,故D错误.故选D.
I3-(aq)的△H<0,故A正确;B、该反应的正反应为放热反应,升高温度,平衡向逆反应方向移动,温度越高,平衡常数越小,若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2,故B正确;C、若反应进行到状态D时,反应未达到平衡状态,若反应趋向于平衡,则反应向生成的I3-方向移动,则v正>v逆,故C正确;D、状态A与状态B相比,B状态相当于在A的基础上升高温度,平衡向逆反应方向移动,则状态B的c(I2)大,故D错误.故选D.
考点:本题考查了化学平衡移动图象问题,题目难度不大,注意分析化学方程式的特征以及温度、压强对平衡移动的影响。


科目:高中化学 来源: 题型:
 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如下图所示(曲线上任何一点都表示平衡状态)下列说法不正确的是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如下图所示(曲线上任何一点都表示平衡状态)下列说法不正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
(2010?广州二模)I2在KI溶液中存在下列平衡:I2(aq)+I-?I3-(aq).测得不同温度下该反应的平衡常数K如下表:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)═I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)═I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
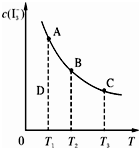 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq).某I2和KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq).某I2和KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )| A、反应I2(aq)+I-(aq)?I3-(aq)的△H<0 | B、若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1<K2 | C、若反应进行到状态D时,一定有v正<v逆 | D、状态A与状态B相比,状态A的c(I2)大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com