
| A、①②③④ | B、④⑤⑥ |
| C、②④⑥ | D、②③⑤ |


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
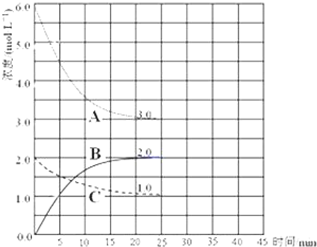 目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ/mol;
目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ/mol;查看答案和解析>>
科目:高中化学 来源: 题型:
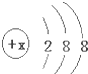 有几种元素的微粒的最外电子层结构如图所示,其中:
有几种元素的微粒的最外电子层结构如图所示,其中:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、9 g H2O和0.5molBr2 |
| B、5.6LN2(标准状态)和11 g CO2 |
| C、10 g H2和10 g O2 |
| D、224mlH2(标准状态) 和0.1molN2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热蒸干灼烧FeCl3溶液,最后所得固体为Fe(OH)3 |
| B、将pH=4的醋酸溶液稀释后,溶液中所有离子浓度都降低 |
| C、pH相同,体积相同的醋酸溶液和稀硫酸分别与足量锌充分反应,产生氢气的量相同 |
| D、若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性:NaA<NaB |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.2g NaHSO4晶体中阳离子和阴离子的总数为0.03 NA |
| B、标准状况下,11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA |
| C、500℃、30MPa下:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ?mol-1;将1.5NA的H2和过量N2在此条件下充分反应,放出热量19.3kJ |
| D、60 g石英晶体中含有的Si-O键数目为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com